- 导言
- 第一节 对于简单物质表的观察"> 第一节 对于简单物质表的观察
- 第二节 对于复合根的观察"> 第二节 对于复合根的观察
- 第三节 对于光和热素与不同物质的化合物的观察"> 第三节 对于光和热素与不同物质的化合物的观察
- 第四节 关于氧与简单物质的化合物的观察"> 第四节 关于氧与简单物质的化合物的观察
- 第五节 对于氧与复合根的化合物的观察"> 第五节 对于氧与复合根的化合物的观察
- 第六节 对于氮与简单物质的化合物的观察"> 第六节 对于氮与简单物质的化合物的观察
- 第七节 对于氢及其与简单物质的化合物的观察"> 第七节 对于氢及其与简单物质的化合物的观察
- 第八节 对于硫及其化合物的观察"> 第八节 对于硫及其化合物的观察
- 第九节 对于磷及其化合物的观察"> 第九节 对于磷及其化合物的观察
- 第十节 对于炭及其与简单物质的化合物的观察"> 第十节 对于炭及其与简单物质的化合物的观察
- 第十一节 对于盐酸根、萤石酸根、月石酸根及其化合物的观察"> 第十一节 对于盐酸根、萤石酸根、月石酸根及其化合物的观察
- 第十二节 对于金属相互化合物的观察"> 第十二节 对于金属相互化合物的观察
- 第十三节 对于亚硝酸和硝酸及其与成盐基的化合物的观察"> 第十三节 对于亚硝酸和硝酸及其与成盐基的化合物的观察
- 第十四节 对于硫酸及其化合物的观察"> 第十四节 对于硫酸及其化合物的观察
- 第十五节 对于亚硫酸及其化合物的观察"> 第十五节 对于亚硫酸及其化合物的观察
- 第十六节 对于亚磷酸和磷酸及其化合物的观察"> 第十六节 对于亚磷酸和磷酸及其化合物的观察
- 第十七节 对于碳酸及其化合物的观察"> 第十七节 对于碳酸及其化合物的观察
- 第十八节 对于盐酸和氧化盐酸及其化合物的观察"> 第十八节 对于盐酸和氧化盐酸及其化合物的观察
- 第十九节 对于硝化盐酸及其化合物的观察"> 第十九节 对于硝化盐酸及其化合物的观察
- 第二十节 对于萤石酸及其化合物的观察"> 第二十节 对于萤石酸及其化合物的观察
- 第二十一节 对于月石酸及其化合物的观察"> 第二十一节 对于月石酸及其化合物的观察
- 第二十二节 对于砷酸及其化合物的观察"> 第二十二节 对于砷酸及其化合物的观察
- (9) 的观察">id="sec043" 第二十三节 对于钼酸及其与成盐基的化合物 (9) 的观察
- 第二十四节 对于钨酸及其化合物的观察"> 第二十四节 对于钨酸及其化合物的观察
- 第二十五节 对于亚酒石酸及其化合物的观察"> 第二十五节 对于亚酒石酸及其化合物的观察
- (11) ">id="sec048" 第二十六节 对于苹果酸及其与成盐基的化合物的观察 (11)
- 第二十七节 对于柠檬酸及其化合物的观察"> 第二十七节 对于柠檬酸及其化合物的观察
- 第二十八节 对于焦亚木酸及其化合物的观察"> 第二十八节 对于焦亚木酸及其化合物的观察
- (14) 的观察">id="sec053" 第二十九节 对于焦亚酒石酸及其与成盐基的化合物 (14) 的观察
- 第三十节 对于焦亚黏酸及其化合物的观察"> 第三十节 对于焦亚黏酸及其化合物的观察
- 第三十一节 对于草酸及其化合物的观察"> 第三十一节 对于草酸及其化合物的观察
- 第三十二节 对于亚醋酸及其化合物的观察"> 第三十二节 对于亚醋酸及其化合物的观察
- 第三十三节 对于醋酸及其与成盐基的化合物的观察"> 第三十三节 对于醋酸及其与成盐基的化合物的观察
- 第三十四节 对于琥珀酸及其化合物的观察"> 第三十四节 对于琥珀酸及其化合物的观察
- (18) 的观察">id="sec064" 第三十五节 对于安息香酸及其与成盐基的化合物 (18) 的观察
- (20) 的观察">id="sec065" 第三十六节 对于樟脑酸及其与成盐基的化合物 (20) 的观察
- (21) 的观察">id="sec066" 第三十七节 对于棓酸及其与成盐基的化合物 (21) 的观察
- (23) 的观察">id="sec067" 第三十八节 对于乳酸及其与成盐基的化合物 (23) 的观察
- 第三十九节 对于糖乳酸及其与成盐基的化合物的观察"> 第三十九节 对于糖乳酸及其与成盐基的化合物的观察
- 第四十节 对于蚁酸及其化合物的观察"> 第四十节 对于蚁酸及其化合物的观察
- (25) 的观察">id="sec072" 第四十一节 对于蚕酸及其与成盐基的化合物 (25) 的观察
- 第四十二节 对于皮脂酸及其化合物的观察"> 第四十二节 对于皮脂酸及其化合物的观察
- (26) 的观察">id="sec075" 第四十三节 对于石酸及其与成盐基的化合物 (26) 的观察
- 第四十四节 对于氰酸及其化合物的观察"> 第四十四节 对于氰酸及其化合物的观察
导言
假若我严格实施了我最初制订的撰写本书的计划,那么在构成这一部分的各种表格及相应的观察结果中,我就只会涉及几种已知酸的简略定义和对一些方法的概略说明,用这些方法,只要对这些酸与各种成盐基的化合所产生的中性盐加以命名或枚举,就可以得到它们。但是我后来发现,增补类似的表,把成为酸和氧化物的组成部分的一切简单物质,以及这些元素各种可能的化合物都包括进来,会极大地增加本书的效用而不致增加很多篇幅。这些增补包括在这一部分的前十二节及附加于这些节的表中,多少算是对第一部分前十五章的概括。其余各表各节则包括所有的含盐化合物。
十分明显的是,在本书的这一部分之中,我较多地借用了德·莫维先生在《物质次序全书》(Encyclopedie par ordre des Matières )第一卷中已经发表了东西。我没能发现更好的信息来源,当考虑到查阅外文书籍的困难时尤为如此。我这样承认,是为了避免麻烦,免得在我的以下部分中引用德·莫维先生的著作。
简单物质表
属于整个自然界的简单物质,这些简单物质可以看做是物体的元素。
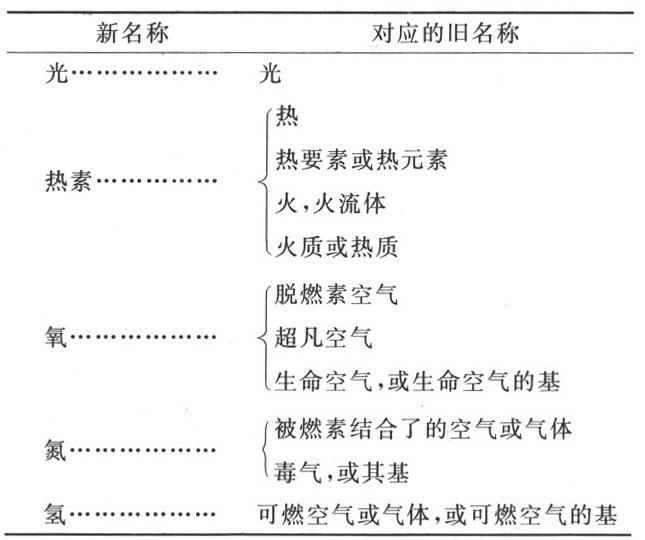
可氧化与可酸化的简单非金属物质
可氧化与可酸化的简单金属物体
可酸化简单土质物质
第一节 对于简单物质表的观察
化学实验的首要目的是分解中性盐,以便分别检验成为其组成部分的不同物质。考虑到各种化学体系,就将发现,化学分析这门科学在我们这个时代进展迅速。以前,油和盐被认为是物体的元素,而后来的观察和实验则表明,一切盐都不是简单的,而是由酸与基结合而成的。现代发现已经极大地扩展了分析的范围 (1) ;酸被表明是由氧这种所有酸的共同的酸化要素,在每种酸中与一种特定的基结合而成的。我曾经证明了哈森夫拉兹(Hassenfratz)先生以前所提出的看法,即酸的这些根全都不是简单元素,它们之中,许多都像油要素一样,是由氢和炭组成的。甚至连中性盐的基都被贝托莱先生证明是化合物,他指出,氨是由氮和氢组成的。
因此,由于化学通过分化和细化而趋于完善,所以不可能说它在何处终结;而且,我们目前假定这些东西是简单的,也许不久就发现完全不是这回事。我们敢于断言某种物质必定是简单的,是就我们目前的知识状态,而且是就化学分析所能表明的而言的。我们甚至可以假定,土质必定很快就不再被认为是简单物体;它们不过是不具与氧结合倾向的成盐类物体;而且我极倾向于相信,这是由于它们已经被该元素饱和所致。如果是这样的话,它们就将被认为是由简单物质,或许是被氧化到一定程度的金属物质组成的化合物。这只是冒险的猜想,我希望读者注意不要把我当成真理所陈述的、建立在观察和实验的坚实基础上的意见,与假设的猜想给弄混淆了。
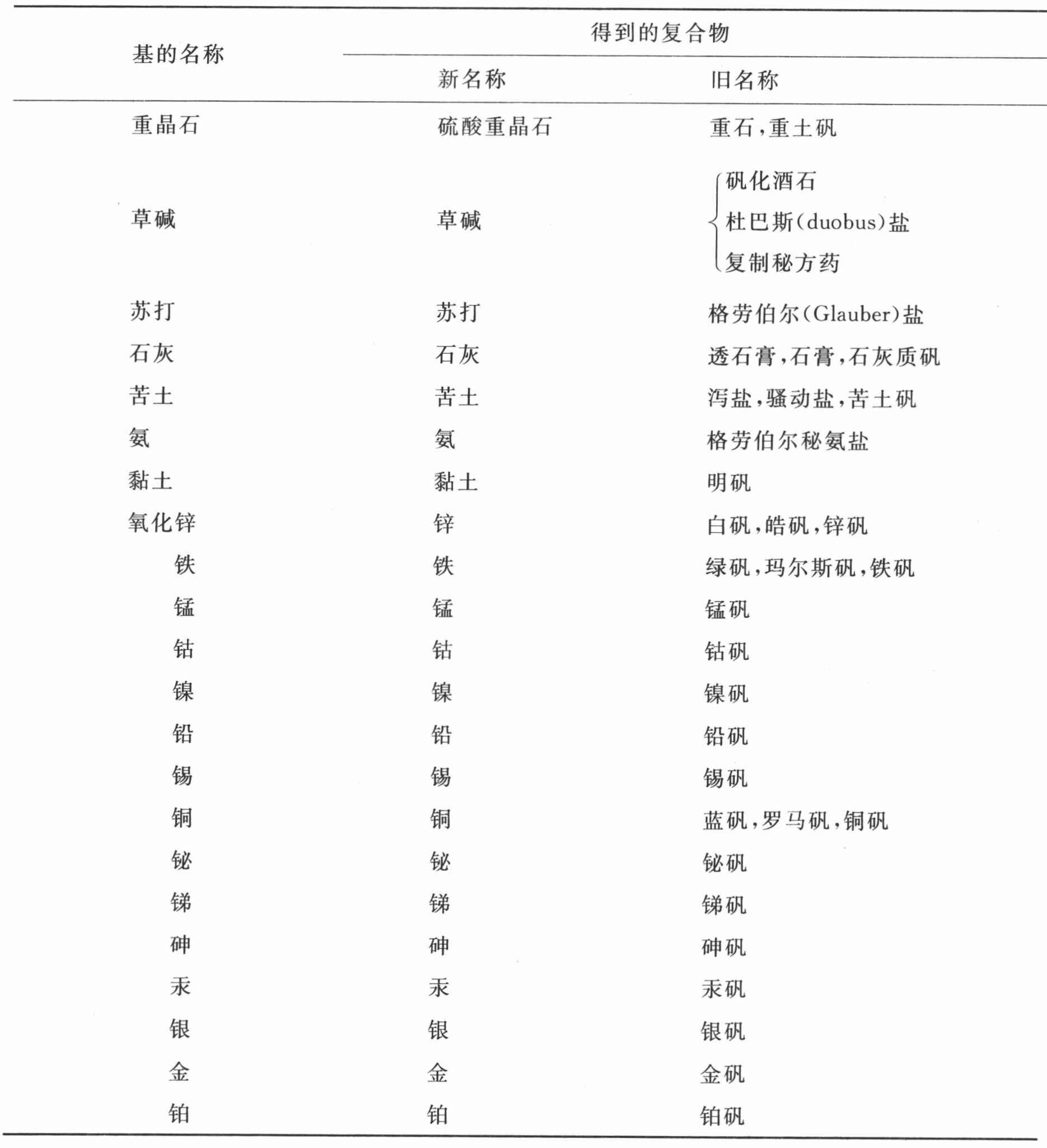
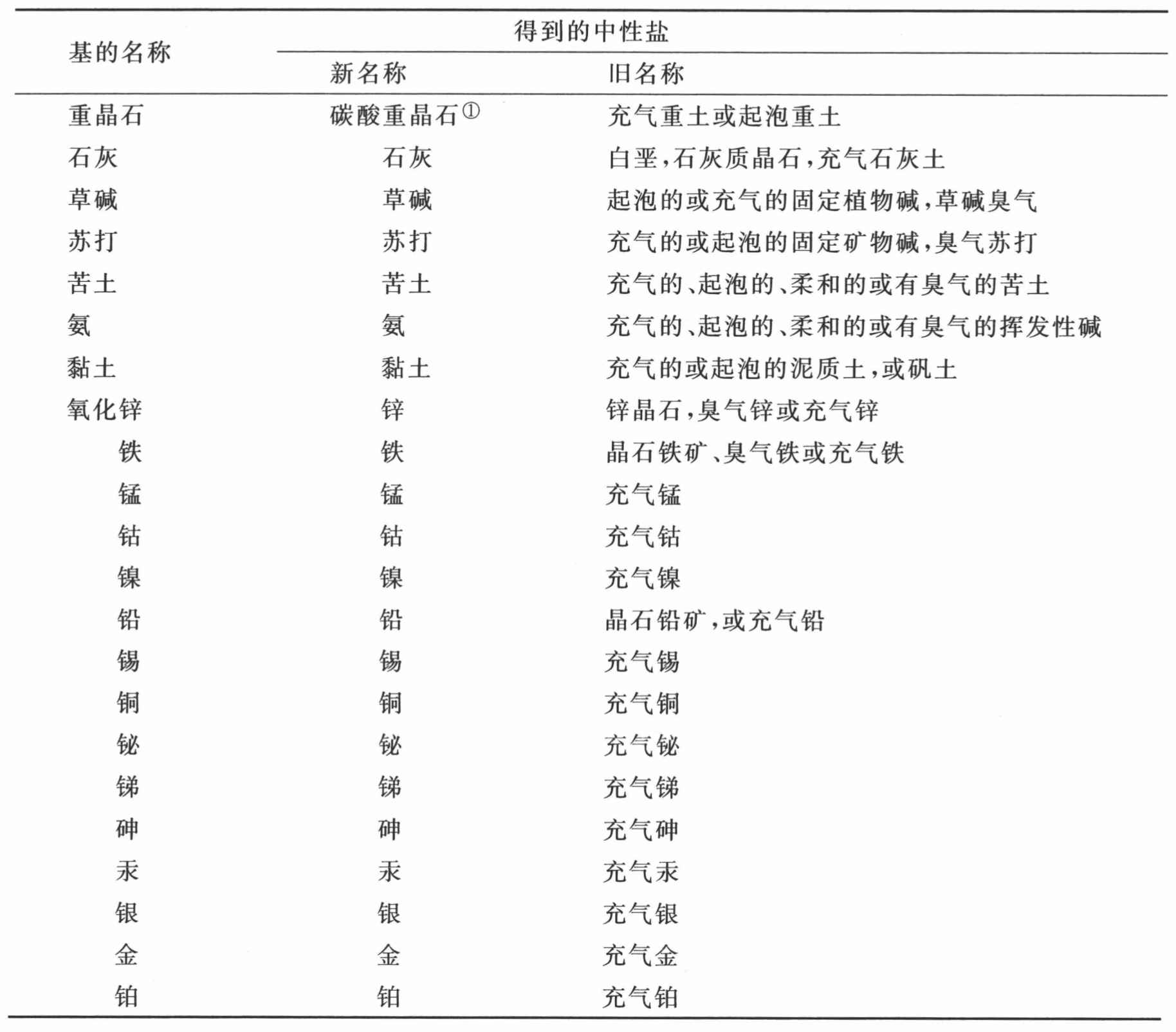
固定碱、草碱和苏打在前表中被略去了,因为它们显然是复合物质,不过迄今为止我们尚不知道组成它们的元素是些什么。
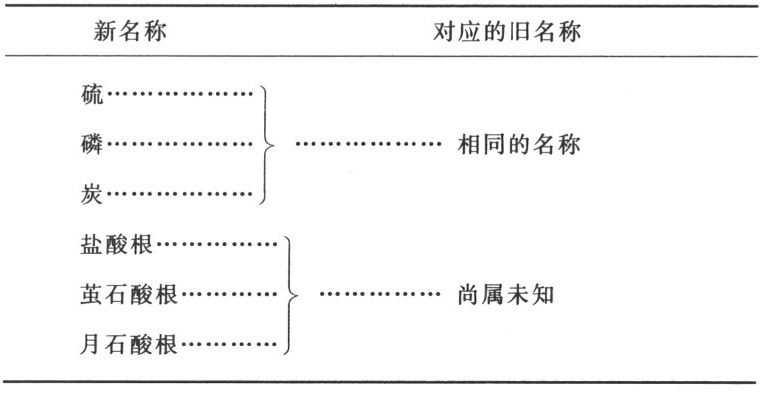
复合的可氧化与可酸化基表

① 来自植物界的根经第一度氧化转变成为植物氧化物,譬如糖、淀粉、树胶或黏液;动物界的根经同样方式形成动物氧化物,如淋巴,等等。——A
第二节 对于复合根的观察
由于以前的化学家们不了解酸的组成,不觉得它们是由各自特定的根或基与一种酸化要素或一切酸共有的元素结合而形成的,因而他们就不会给他们连极隐约看法都没有的物质命名。因此,我们只得就这个问题发明一种新的命名法,不过我们同时感觉到,当复合根的本质得到较好理解时,这种命名法必定能够大大修改 (2) 。
前表中列举的来自植物界和动物界的复合可氧化与可酸化根,不能用系统命名法命名,因为它们的确切分析迄今尚属未知。通过我本人的某些实验以及哈森夫拉兹先生的某些实验,我们只是一般的知道,大多数植物酸,譬如亚酒石酸、草酸、柠檬酸、苹果酸、亚醋酸、焦亚酒石酸、焦亚黏酸,都是由氢和炭以形成单个基的方式化合而成的根,而且,这些酸只是由于成为它们的基的组成部分的这两种物质的比例,以及这些基所受到的氧化程度,而彼此有别。主要是由贝托莱先生的实验,我们进一步知道,来自动物界的根,以及来自植物界的某些根,是更为复合的一类,而且,除了氢和炭之外,它们通常含有氮,有时含有磷;不过我们并未掌握足够精确的实验,用来计算这几种物质的比例。因此,我们被迫按照老化学家们的方式,还是依据这些酸由之获得的物质去命名它们。可能无疑的是,当我们关于这些物质的知识变得更加精确和广博时,这些名称就将被放弃;那时,氢-亚碳、氢-碳、碳-亚氢以及碳-氢 (3) 这些术语就将取代我们现在所使用的术语,而我们现在所使用的术语就将仅仅作为不完善状态的证据而留存,化学的这一部分就是以这种不完善状态由我们的前辈留传给我们的。
显然,由氢和炭化合而成的油,是真正的碳-亚氢或氢-亚碳根;而且,通过增加氧,它们的确可依其氧化度而转变成为植物氧化物和酸。然而,我们却不能断言说,各种油以其完整的状态成为植物氧化物和植物酸的组成部分;它们可能事先就失去了部分氢和炭,剩下的成分不再以构成油所必需的比例存在。我们还需要进一步的实验来阐明这些观点。
严格说来,我们仅仅知道一种来自矿物界的复合根,即硝-盐酸根,此根由氮与盐酸根化合形成。其他复合矿物酸由于很少产生惊人的现象,因而就更谈不上引人关注了。
第三节 对于光和热素与不同物质的化合物的观察
我没有构建关于光和热素与各种简单物质和复合物质的化合物的表格,因为我们关于这些化合物的本质的概念迄今尚不够精确。一般说来,我们知道,一切物体事实上都以各种方式被热素所充满、包围和渗透,它填满了物体的粒子之间所留下的每一个空隙;在某些情况下,热素固定于物体之中,甚至成为固体物质的组成部分,不过更常见的是它用推斥力作用于它们,固体转化为液体、液体转化为气态弹性,便完全是由于这种力,或者这种力在物体中累积到某个或大或小的程度所致。我们已经使用气这个属名,表示由于热素的充分积累所产生的物体的这种气体状态,这样,当我们想要表达盐酸、碳酸、氢、水、醇等的气体状态时,我们只要在它们的名称上加上气这个字就行了;譬如盐酸气、碳酸气、氢气、水汽、醇气,等等。
光的各种化合物以及它对不同物体作用的方式,仍然知之甚少。根据贝托莱先生的实验,它似乎对氧有大的亲和力,能与之化合,并与热素一起使之变成气体状态。关于植物生长的实验使人们有理由相信,光与植物的某些部分化合,而且,植物叶子的绿色、它们的各种花朵的颜色,主要就是这种化合所致。这一点是肯定的,即,在黑暗中生长的植物完全是白色的、衰弱的和不健康的,而且,要使它们恢复活力、获得其自然颜色,光的影响是绝对必需的。类似的事情甚至发生在动物身上:人类在从事坐立不动的行业,生活在拥挤的房子之内或大城市的狭窄小巷中时,就退化到一定的程度;而在户外从事大部分乡村劳作时,他们在活力和体质上就得到改善。组织、感觉、本能举动以及一切生命活动,仅仅存在于地球表面及受到光的影响的地方。没有它,大自然就会死气沉沉,毫无生机。造物主的仁慈通过光使地球表面充满了组织、感觉和才智。普罗米修斯(Prometheus) (4) 的神话也许被认为暗示了这条哲学真理,它本身恰恰就是向古人的知识提供的。我在本书中有意回避与有机体有关的专题研究,由于这个原因,呼吸、血液生成与动物热现象就没有考虑;但我希望在将来的某个时间,能够阐明这些奇妙的问题。
第四节 关于氧与简单物质的化合物的观察
氧几乎构成了我们大气团的三分之一,因此是自然界中最丰富的物质之一。一切动物和植物都生存和成长于这种无限的氧气宝库之中,而且,我们在实验中使用的氧绝大部分便由此获得。这种元素与其他物质之间的相互亲和力如此之大,以致我们不能使其从整个化合物中离析出来。它在大气中以氧气的状态与热素结合,再与重量约为其三分之二的氮气混合。
使某一物体被氧化或者让氧成为与该物体化合物的一部分,需要几个条件。第一,要被氧化的物体的粒子所具有的与其他物质的相互吸引力,必须比它们所具有的对氧的吸引力小,否则它就不可能与它们化合。在这种情况下,自然可以得人工之助,我们用我们的力量几乎是任意地通过加热,换言之,就是把热素引入它们的粒子之间的空隙之中,使其减少物体粒子的吸引力;而且,由于这些粒子的彼此吸引的减小与其距离成反比,那么,显然当粒子所具有的彼此亲和力变得比它们对氧的亲和力小时,粒子距离上必定存在某点,在这一点上,如果有氧存在的话,氧化就必定发生。
我们容易设想,这种现象由之开始的热度在不同物体中必定不同。因此,为了氧化大多数物体,尤其是大部分简单物质,必须使它们在适当的温度下受空气的影响。就铅、汞和锡而言,所需要的几乎只比地球的环境温度略高一点;但用干法即操作中没有水分参与时,氧化铁、铜等等就需要高得多的热度。有时,氧化发生得极为迅速,并伴有很明显的热、光、焰;磷在空气中的燃烧以及铁在氧气中的燃烧便是如此。硫的氧化不太迅速;铅、锡以及大多数金属的氧化发生得极为缓慢,因此,热素尤其是光的离析几乎察觉不到。
有些物质对氧的亲和力很强,以很低的温度与其化合,使我们不能在它们的非氧化态获得它们,盐酸便是如此,它迄今尚未被人工分解,甚至可能也没有被自然所分解,因此只有在酸的状态才找得到它。很可能的是,矿物界的许多其他物质在通常的大气温度下不可避免地被氧化了,而由于已经被氧所饱和,这就会阻止它们对该元素的进一步作用。
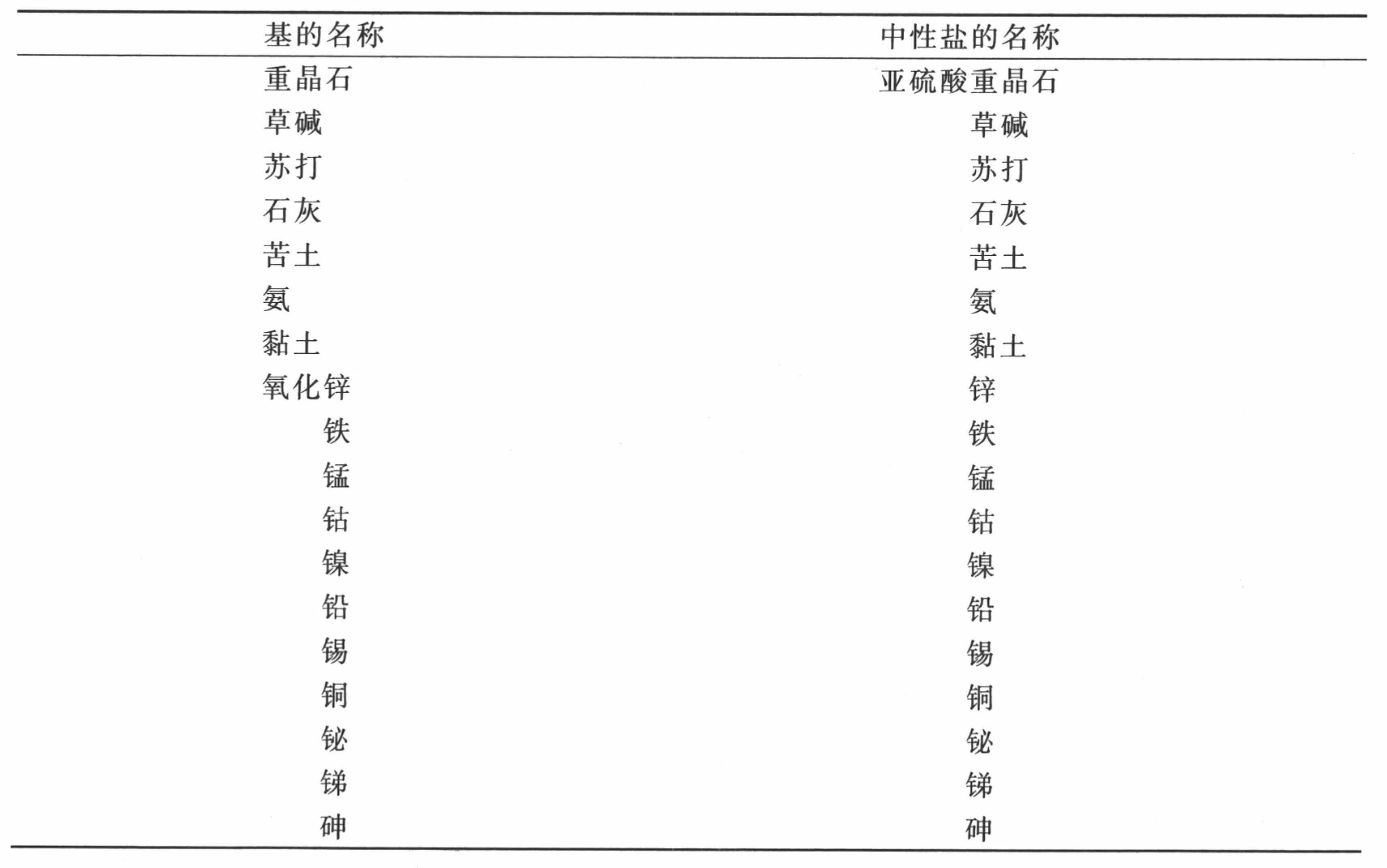
氧与简单物质的二元化合物表
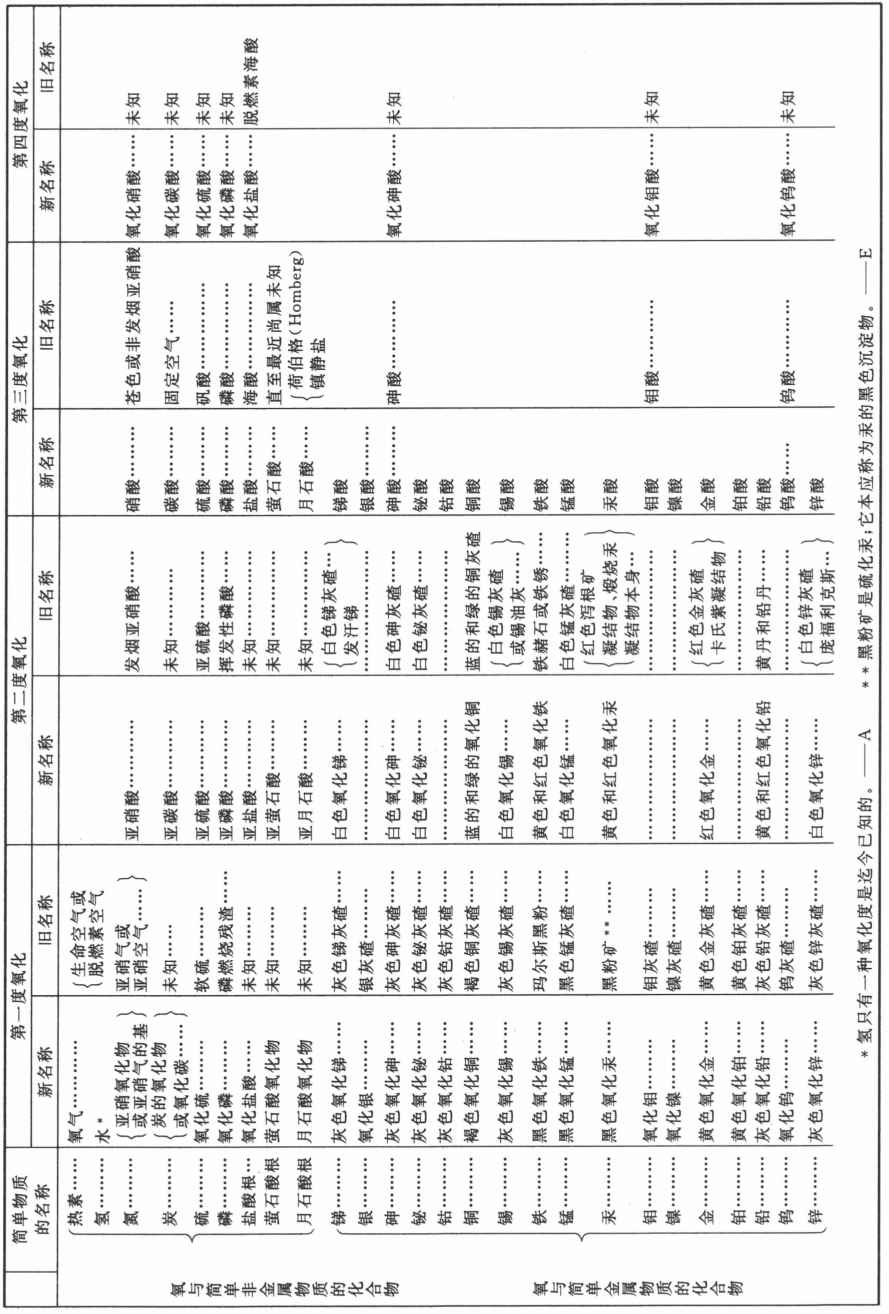
除了在一定温度下暴露于空气中之外,还有其他一些使简单物质氧化的方法,譬如,将它们置于与氧化合了的并且所具有的与该元素的亲和力极小的那些金属的接触之中。红色氧化汞便是具有这种效果的最好的物质之一,它对于那些不与该金属化合的物体来说尤其如此。在这种氧化物中,氧以极小的力与该金属结合,只要有足以使玻璃炽热的热度,就能将其驱除;因此,能与氧结合的那些物体,通过与红色氧化汞混合并适度加热,就很容易被氧化。用黑色氧化锰、红色氧化铅、各种氧化银以及大多数金属氧化物,在一定程度上也可以产生同样的效果,只要我们注意选择那些对氧的亲和力比要被氧化的物体对氧的亲和力小的物体就行。一切金属的还原和再生都属于这类操作,不过是用几种金属氧化物使炭氧化而已。炭与氧和热素结合,以碳酸气的形式逸出,而金属则变纯,并得以再生,即丧失了以前以氧化物的形式与之化合的氧。
一切可燃物质与草碱或苏打的硝酸盐,或与草碱的氧化盐酸盐混合,并受一定程度的热,也可以被氧化;在这种情况下,氧离开硝酸盐或盐酸盐,与可燃物体化合。这种氧化需要极端谨慎并以极小的量来完成;因为,由于氧是几乎与将其转化成为氧气所必需的热素同样多的热素化合了的硝酸盐,尤其是氧化盐酸盐的组成部分,因此,氧一与可燃物质化合,这么大量的热素就迅速游离,并引起完全不可抗拒的剧烈爆炸。
我们可以用湿法氧化大多数可燃物体,并将自然三界的大多数氧化物转变成为酸。为此目的,我们主要使用硝酸,它对氧控制得极微弱,借微火之助它就将其释放给许多物体。氧化盐酸可用于这种操作的若干种,但不是所有的这种操作。
我把二元这个名称赋予氧与简单物质的化合物,因为在这些化合物中只有两种元素化合。当三种物质结合成一种化合物时,我将其称为三元的,当化合物由四种物质结合而成时则称为四元的。
氧与复合根的化合物表

① 这些根经一度氧化形成植物氧化物,如糖、淀粉、黏液,等等。——A
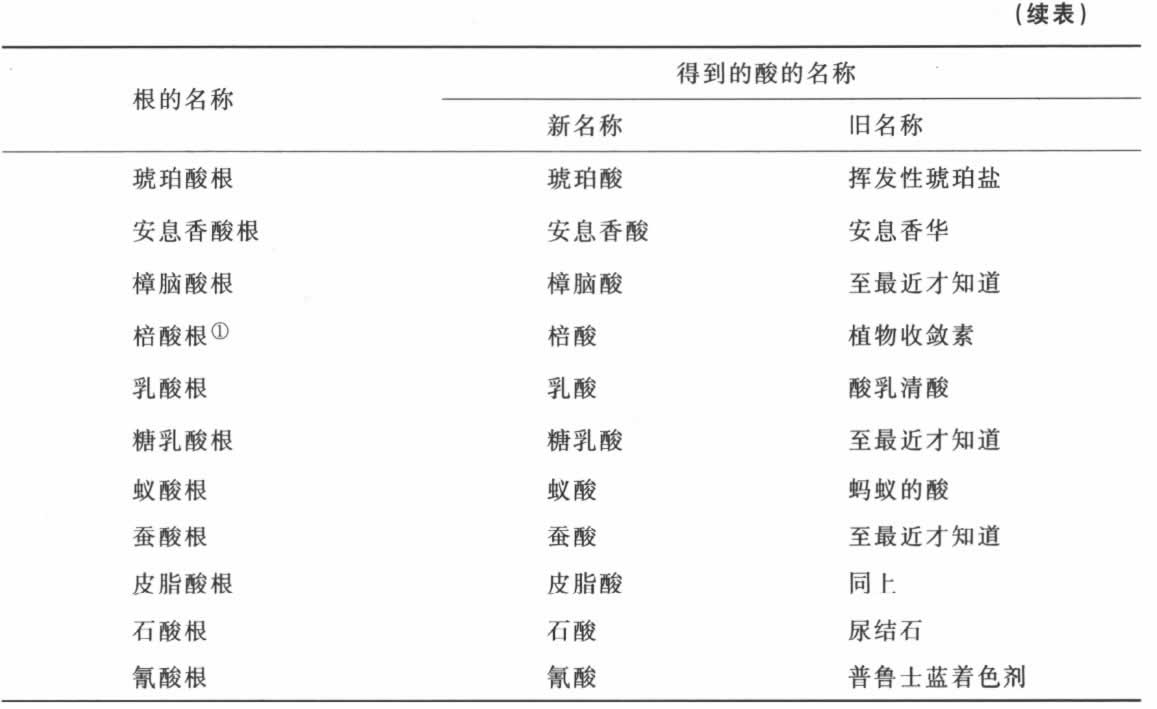
① 这些根经一度氧化形成动物氧化物,如淋巴、血液的红色部分、动物分泌物,等等。——A
第五节 对于氧与复合根的化合物的观察
在《科学院文集》1776年第671页和1778年第535页,我发表了一个关于酸的本质与形成的新理论,我在其中断定酸的数目必定比到当时为止所想象的要多得多。自那时以来,已经向化学家们开辟了一个新的探究领域;酸不是当时所知道的五六种,几手有三十种新的酸被发现了,靠这些新的酸,已知中性盐的数目已经按同样比例增加了。酸的可酸化基或根的本质,以及它们可氧化的程度,仍待探究。我已经指出,出乎所有来自矿物界的可氧化与可酸化根都是简单的,并指出,正相反的是,在植物界尤其是动物界,除了至少是由氢和炭两种物质组成的根以外,几乎不存在任何根,还指出,氮与磷通常结合成根,由于这些根,我们就有了由二、三、四种简单元素结合而成的复合根。
根据这些观察,植物和动物的氧化物和酸似乎在三个方面彼此有别:第一,随它们的根由之组成的简单可酸化元素的数目的不同而有别;第二,随它们化合起来的比例的不同而有别,第三,随它们氧化度的不同而有别。这些情况足以解释自然以这些物质所创造的大量种类。既然如此,就全然用不着惊奇,只要改变氢和炭在其组成中的比例并使它们以或大或小的程度氧化,大多数植物酸可以互相转变。这已经由克雷尔(Crell)先生用一些非常巧妙的实验做成了,哈森夫拉兹先生证实并扩展了这些实验。根据这些实验看来,似乎炭和氢经一度氧化产生亚酒石酸,经二度氧化产生草酸,经三度或更高度氧化产生亚醋酸和醋酸;只是炭似乎以相当小的比例存在于亚醋酸和醋酸之中。柠檬酸和苹果酸与上述诸酸略有差异。
那么,我们应当得出断言说油就是植物酸和动物酸的根吗?我已经表示过我对这个问题的疑问:第一,尽管油似乎不过是由氢和炭形成的,但我们并不知道它们是否是按组成酸根所需要的精确比例形成的;第二,由于氧与氢和炭一样成为这些酸的组成部分,因此,就没有理由设想它们是由油而不是由水或碳酸组成的。果然不错,它们含有所有这些化合物所必需的材料,但是这些在通常的大气温度下并不发生;所有这三种元素仍然被化合了,处于一种用比沸水温度只高一点的温度就能迅速破坏的平衡状态 (5) 。
氮与简单物质的二元化合物表

第六节 对于氮与简单物质的化合物的观察
氮是最丰富的元素之一;它与热素化合形成氮气,即臭气,构成将近三分之二的大气。这种元素在常压常温下总是处于气体状态,迄今为止的压缩程度和冷却程度尚不能将其还原为固体或气体形态。它也是动物物体的基本组成元素之一,在动物物体中它与炭和氢,有时与磷化合;这些元素靠一部分氧而被结合在一起,它们靠氧按照氧化程度形成氧化物或酸。因此,动物物质与植物物质一样,因三个方面的不同而不同:第一,根据成为基或根的组成部分的元素数目的不同而不同;第二,根据这些元素的比例的不同而不同;第三,根据氧化程度的不同而不同,氮与氧化合时,形成氧化亚氮、氧化氮、亚硝酸和硝酸;与氢化合时产生氨。它与其他简单元素的化合物所知甚少;对于这些物质,我们赋予氮化物(azurets )这个名称,用化物(uret )这个词尾表示一切非氧化的复合物。极有可能的是,也许今后将发现一切碱性物质都应归入这一类氮化物中。
用一种硫化草碱或硫化石灰溶液,吸收与氮气混合的氧气,可以获得氮气。完成这个程序需要12或15天,在此期间,必须通过搅动和破坏溶液顶部形成的表膜。它还可以通过将动物物质溶解于微热的稀硝酸中而获得。在这种操作中,氮以气体形式离析,我们在气体化学装置中充满水的玻璃钟罩之下收集它。我们可以用炭或其他可燃物质爆燃硝石获得这种气体;用炭时,氮气与碳酸气混合,碳酸气可以用苛性碱溶液或石灰水吸收,此后氮气就是纯的了。我们还可以像德·佛克罗伊先生指出的那样,用第四种方式从氨与金属氧化物的化合物获得它:氨的氢与氧化物的氧化合形成水;而游离的氮则以气体形式逸出。
氮的化合物只是最近才发现:卡文迪什(Covendish)先生首先在亚硝气和亚硝酸中观察到它,贝托莱先生则在氨和氰酸中观察到它。由于它分解的证据迄今尚未出现,所以我们完全有资格认为氮是一种简单的基本物质。
氢与简单物质的二元化合物表

① 这些化合物发生在气体状态,分别形成硫化氧气和磷化氧气。——A
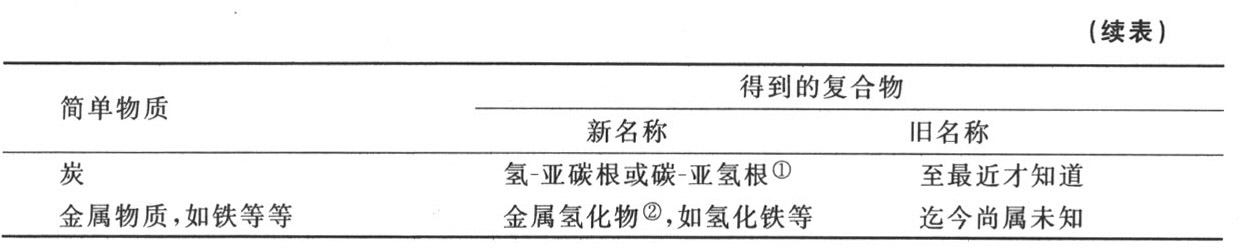
① 这种氢与炭的化合物包括固定油与挥发性油,并且形成相当大部分的植物氧化物、植物酸、动物氧化物和动物酸的根。当它在气体状态发生时就形成碳酸氢气。——A
② 这些化合物尚不知道,由于氢对热素的极大亲和力,它们很可能不能存在,至少在通常的气温下是如此。——A
第七节 对于氢及其与简单物质的化合物的观察
氢正如它的名称所表达的,是水的组成元素之一,它在重量上形成了水的百分之十五份,与百分之八十五份氧化合。其性质甚至其存在直到最近才知道的这种物质,丰富地分布于自然界,在动物界和植物界的各种过程中起着非常重要的作用。由于它所具有的对热素的亲和力大得使它只能以气态存在,因此,不可能在固态或液态独立于化合物得到它。
要获得氢,更确切地说是获得氢气,我们只有使水受某种物质的作用,氧对这种物质的亲和力要比它对氢的亲和力更大;以这种方式,氢处于游离态,通过与热素结合,便取氢气的形态。炽热的铁常常被用于这种目的。在此过程中,铁被氧化,变成像埃尔巴岛(Elba)铁矿那样的一种物质。在这种氧化物状态,它几乎不能被磁铁所吸引,并溶解于酸而无泡腾。
处于炽热状态的炭,通过吸引氢化合物中的氧,也具有分解水的同样的能力。在此过程中,碳酸气形成并与氢气混合,不过它易于被水或碱所离析,水或碱吸收碳酸,使氢气处于纯态。将铁或锌溶解于稀硫酸,我们也能得到氢气。这两种金属单独使用时,分解水极其缓慢、极其困难,但有硫酸帮助时则分解得容易而迅速;氢在此过程中与热素结合,以氢气的形态离析出来,而水的氧则与金属结合成氧化物形成式,氧化物立即溶解于酸,形成硫酸铁或硫酸锌。
某些非常杰出的化学家认为氢就是施塔尔的热素;而由于这位大名鼎鼎的化学家承认燃素存在于硫、炭、金属等等之中,他们当然就不得不设想氢存在于所有这些物质之中,不过他们却不能证明他们的设想;即使他们能证明,这个设想也不会是很有利的,因为氢的这种离析完全不足以解释煅烧和燃烧现象。我们必须不断提到对这个问题的考察,即“在不同类型的燃烧过程中离析的热和光是由燃烧物体抑或是在所有这些操作中化合的氧提供的呢?”氢被离析的猜测的确无论如何都没说明这个问题。而且,它属于那些进行猜测去证明它们的人们;无疑,一个没有任何猜测的学说对现象的解释与他们的学说靠猜测对现象的解释同样好,同样自然,而且至少具有简单得多的优点 (6) 。
硫与简单物质的二元化合物表

第八节 对于硫及其化合物的观察
硫是一种可燃物质,具有极强的化合倾向;它在常温下自然处于固态,使它液化需要比沸水稍高一点的热。硫在火山附近以相当的纯度自然形成;我们还发现它主要以硫酸状态与矾页岩中的黏土以及石膏中的石灰等等化合着。用处于炽热的炭夺去其中的氧,就可以从这些化合物使其处于硫的状态;碳酸形成,并以气体状态逸出;硫仍与陶土、石灰等化合着,处于硫化物状态,硫化物被酸分解;酸与土结合成为中性盐,硫就沉淀下来。
磷与简单物质的二元化合物表
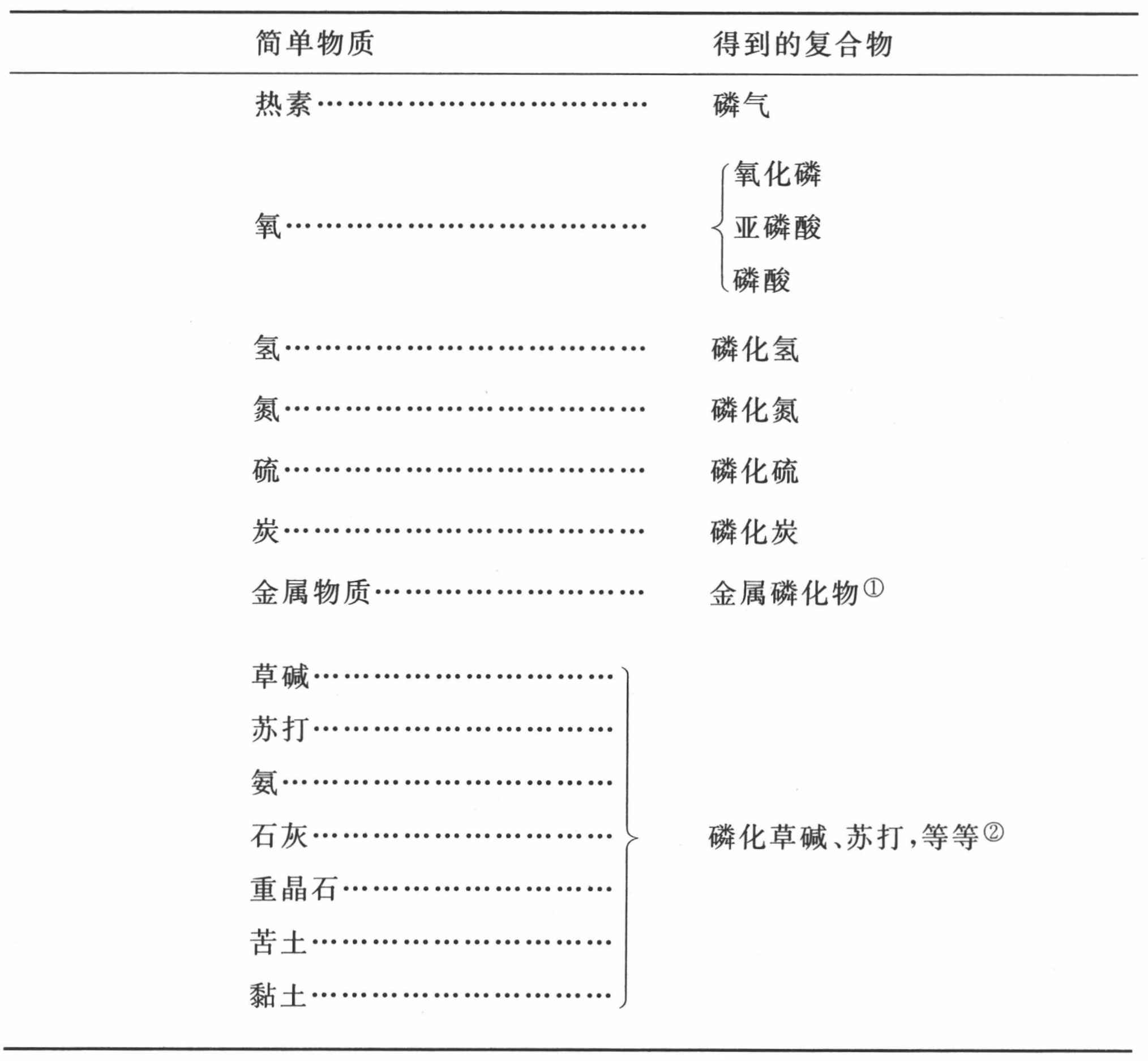
① 在磷与金属的所有这些化合物中,迄今只知道磷与铁形成以前称为菱铁矿的化合物;尚未弄清在这种化合物中,磷是否被氧化了。——A
② 磷与碱和土质的这些化合物尚不知道;根据让·热布雷先生的实验,它们似乎是不可能的。——A
第九节 对于磷及其化合物的观察
磷是一种简单的可燃物质,直到1667年才为化学家们所知,当年由勃兰特(Brandt)发现,他对制取法秘而不宣;不久,孔克尔弄清了勃兰特的制备方法,将其公之于众。自那时起,它一直以孔克尔磷的名称为人所知。很长时间内它都只能从尿中获得;而且,尽管荷伯格在1692年的《科学院文集》中对制取作了说明,但所有的欧洲哲学家却都是从英国弄到磷的。1737年在皇家花园,当着科学院的一个委员会的面,在法国第一次制取了它。现在,按盖恩(Gahn)、舍勒、鲁埃尔等诸位先生的制取法,人们以更方便更经济的方式从动物骨骼中获得它,动物骨骼是真正的石灰质磷酸盐。将成体动物的骨骼煅烧成白色,捣碎,用细丝筛过筛;把一定量的稀硫酸倒在细粉上,稀硫酸的量要少于足以使全部细粉溶解的量。该酸与骨骼的石灰质土质结合成为硫酸石灰,磷酸以液体游离出来。将该液体倾析,用沸水冲洗残留物;让这种冲洗了黏附着酸的水与以前倾析出的液体结合,并将其逐步蒸发;溶解了的硫酸石灰结晶成丝线形状,将其除去并经持续蒸发,我们就得到无色透明玻璃状外观的磷酸。将其弄成粉末状并与其重量三分之一的炭混合,通过升华我们就得到非常纯的磷。用上述办法获得的磷酸,绝没有经燃烧或用硝酸氧化纯磷得到的磷酸纯;因此,在研究性实验中总是应当使用后者。
在几乎所有的动物物质以及稍微做了动物分析的植物中,都发现有磷。在所有这些物质之中,它通常与炭、氢和氮化合,形成复合根,这些根大部分通过与氧的第一度结合而处于氧化物状态。哈森夫拉兹发现磷与炭含在一起,这说明有理由认为它在植物界与通常所猜测的更普通。用适当的方法肯定可以从某些科的植物的每一个体获得它。由于迄今尚无实验说明有理由认为磷是一种复合物体,我已经将它安排在简单或基本物质之列。它在温度计的温度为32°(104°)时着火燃烧。
炭的二元化合物表
第十节 对于炭及其与简单物质的化合物的观察
由于炭迄今尚未被分解,因此在我们目前的知识状态下,它必定被认为是一种简单物质。根据现代实验,它似乎预先形成存在于植物之中;我已经说过,它在植物中与氢,有时与氮和磷化合,形成根据其氧化程度可以变成氧化物或酸的复合根。
要得到植物或动物物质中所含的炭,我们必须使它们起初受温和的火而后受极强的火的作用,以将顽强地附着在炭上的最后的一份水驱除出去。出于化学目的,这通常在缸瓷或瓷质曲颈瓶中进行,将木头或其他物质导入曲颈瓶中,然后将其置于反射炉中,逐渐使其升至极热。此热使物体的能与炭化合成为气态的一切部分挥发或者变成气体,炭就其本性而言更为固定,与少量土质和某些固定盐化合,留在曲颈瓶内。
就炭化木头这件事而言,这是用一种有些昂贵的方法进行的。处理的木头成堆,而且用土覆盖,以便使除了维持火所绝对必需的空气以外的空气的进路受阻,该火一直保持至所有的水和油都被驱除出去,此后,关闭一切气孔使火熄灭。
我们可以通过在空气中,更确切地说是在氧气中燃烧,或者用硝酸,去分析炭。我们在两种情况中都将其转化为碳酸,有时剩下少许草碱及某些中性盐。这种分析迄今几乎没有引起化学家们的注意;我们甚至没有把握,草碱是在燃烧之前就存在于炭中,还是在该过程中经某种未知的化合形成的。
第十一节 对于盐酸根、萤石酸根、月石酸根及其化合物的观察
由于这些物质的化合物,无论是彼此的化合物,还是与其他可燃物体的化合物,都完全不知道,因此我们并没有构造有关它们的命名表的任何企图。我们仅仅知道,这些根可以氧化,可以形成盐酸、萤石酸、月石酸,知道它们以酸的状态成为许多化合物的部分,这在后面详述。化学迄今尚不能使它们解除氧化,制备它们的简单状态。为此目的,必须使用某些物质,氧对这些物质的亲和力要强于氧对上述根的亲和力,无论是靠单独的亲和力,还是靠双重有择吸引力。已知与这些酸根的起源有关的一切,都将留在考虑它们与成盐基的化合物的各节提到。
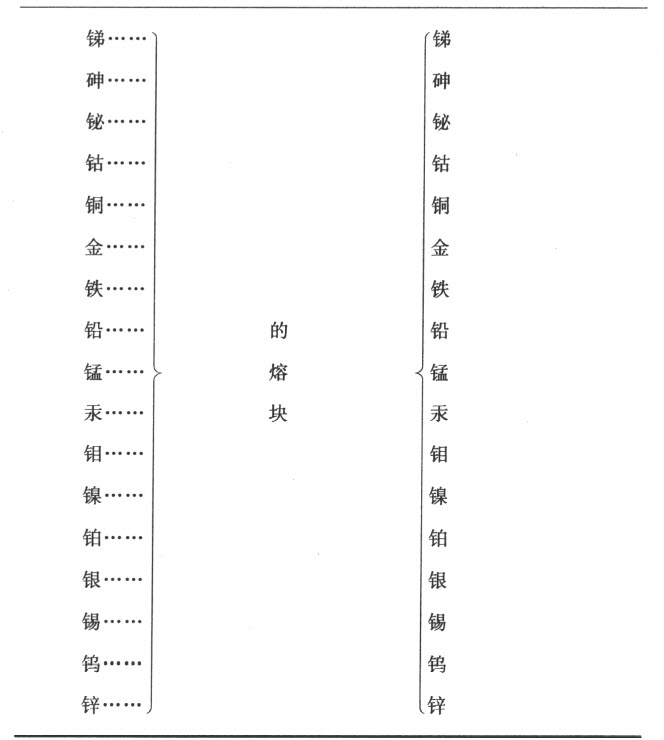
第十二节 对于金属相互化合物的观察
在结束我们对于简单或基本物质的说明之前,人们也许会期望必须提供一份关于合金或金属相互化合物的表;但是,这样一份表的篇幅可能是巨大的,而且没有深入研究一系列尚未尝试的实验也会是极不令人满意的,我认为将其全部略去是适当的。必须提及的只是,这些合金应当根据混合物或化合物中比例最大的金属命名;譬如,金银合金即熔合了银的金这个术语表明金是占优势的金属。
金属的合金与其他化合物一样,有一个饱和点。根据德·拉·布里谢(de la Briche)先生的实验,它们似乎甚至有两个完全截然不同的饱和度。
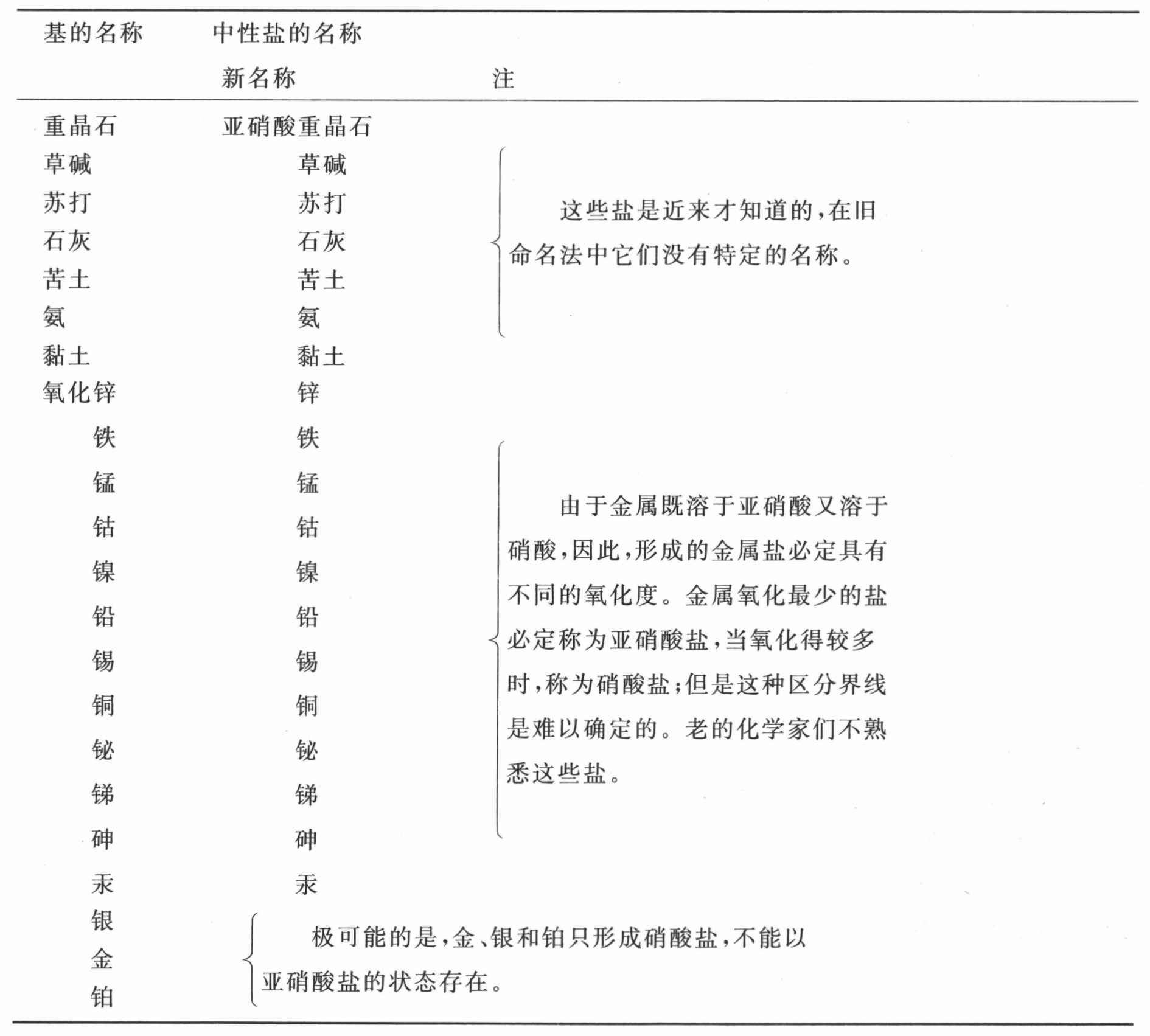
处于亚硝酸状态的氮与成盐基的化合物表
(按照这些基与该酸的亲和力排列)
完全被氧所饱和,处于硝酸状态的氮与成盐基的化合物表
(以成盐基与该酸的亲和力为序)
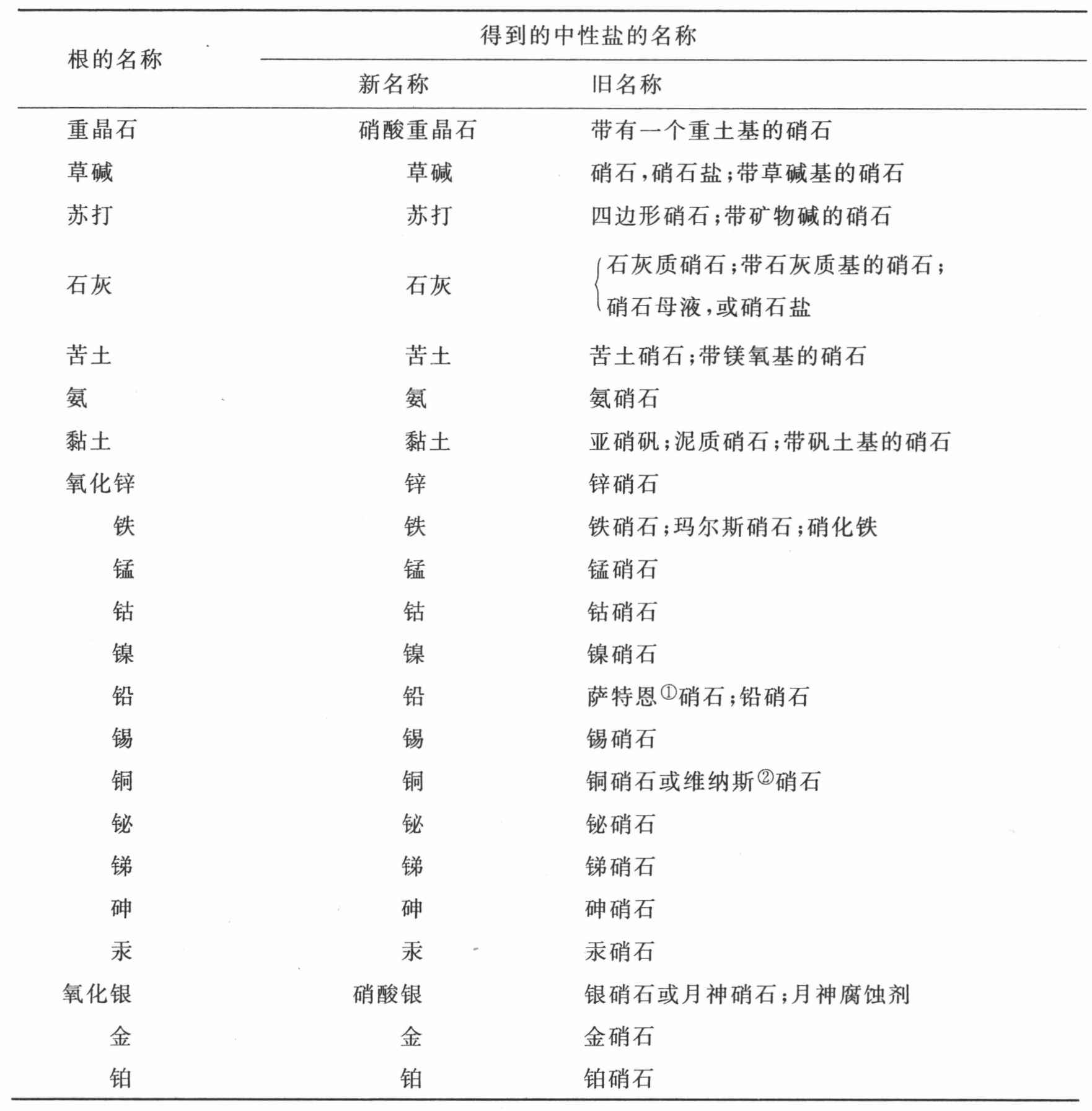
① 萨特恩(Saturn),土星,罗马神话中的农神,西方古代炼金术士用它表示铅——C
② 维纳斯(Venus),金星,罗马神话中爱和美的女神,西方古代炼金术士用它表示铜——C
第十三节 对于亚硝酸和硝酸及其与成盐基的化合物的观察
亚硝酸和硝酸由在技术上以硝石盐的名称长期为人所知的一种中性盐获得。这种盐由旧建筑物垃圾,由地窖、马厩或谷仓以及一切栖居过的地方的土,经浸滤提取。在这些土中、硝酸通常与石灰和苦土,有时与草碱化合,很少与黏土化合。由于所有这些盐除硝酸草碱之外都吸引空气的潮气,因而会难以保存,所以,在硝石盐制造业及豪华优雅住宅的建造中,就利用硝酸对草碱的亲和力比它对其他那些基的亲和力大这一点,借此使石为、苦土和黏土沉淀,而且所有这些硝酸盐都被还原成草碱或硝石盐的硝酸盐。 (7)
将沃尔夫(Woulfe)装置(图版IV,图1 )中的所有瓶子都半充满水并小心用封泥封住所有接头,在与此联结的一个曲颈瓶中用一份浓硫酸分解三份纯硝石盐,经蒸馏便由此盐获得硝酸。亚硝酸以含过量亚硝气的红蒸气,换言之,即未被氧饱和的红蒸气的形式经过。部分酸以暗橘红色液体的形式在接受器中凝结,其余的则与瓶中的水化合。蒸馏过程中,大量的氧气逸出,这是由于在高温下氧对热素的亲和力较它对亚硝酸的亲和力大,尽管在通常的大气温度下这种亲和力是相反的。正是由于氧的离析,中性盐的硝酸在这种操作中转变成为亚硝酸。在柔火上加热它就恢复到硝酸状态,柔火赶走过剩的亚硝气,剩下被水大大稀释了的硝酸。
将极干的黏土与硝石盐混合,可以获得较浓状态的硝酸,损失甚少。将这种混合物放进土质曲颈瓶,用强火蒸馏。黏土与草碱因为它对它的亲和力大而化合,而略含亚硝气的硝酸则从上面离去了。这易于经柔和加热曲颈瓶中的酸而离析;少量的亚硝气进入接受器,极纯的浓硝酸就留在曲颈瓶中。
我们已经明白,氮就是硝酸根。如是给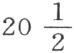 份重量的氮加
份重量的氮加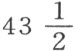 份重量的氧,就形成64份亚硝气;如果我们另外再让36份氧与此结合,由此化合物就产生100份硝酸。数量居这二种氧化端之间的氧,产生不同种类的亚硝酸,换言之,硝酸或少或多含有亚硝气。我是通过分解确定上述比例的;尽管我不能保证它们绝对精确,但它们也不会远离真实情况。卡文迪什先生首次用合成实验说明氮是硝酸的基,他给出的氮的比例比我所给出的略大一点;但是,由于他未必会制得亚硝酸而没制得硝酸,因此,这种情况多少就解释了我们的实验结果中的差异。
份重量的氧,就形成64份亚硝气;如果我们另外再让36份氧与此结合,由此化合物就产生100份硝酸。数量居这二种氧化端之间的氧,产生不同种类的亚硝酸,换言之,硝酸或少或多含有亚硝气。我是通过分解确定上述比例的;尽管我不能保证它们绝对精确,但它们也不会远离真实情况。卡文迪什先生首次用合成实验说明氮是硝酸的基,他给出的氮的比例比我所给出的略大一点;但是,由于他未必会制得亚硝酸而没制得硝酸,因此,这种情况多少就解释了我们的实验结果中的差异。
由于在关于某种哲学性质的所有实验中都需要最大可能的精确度,因此,出于实验目的,我们必须由先前已经清除了一切异物的硝石获得硝酸。如果怀疑蒸馏之后硝酸中还有硫酸,那么,滴入一点点硝酸重晶石,只要有沉淀发生,就易于将其离析开来;由于硫酸有较大的亲和力,它就吸引重晶石,与其形成一种不可溶的中性盐,落至底部。滴入一点点硝酸银,只要有盐酸银沉淀产生,就可以用同样方式清除盐酸。当这两种沉淀终了时,用柔火蒸馏出大约八分之七的酸,馏出物就处于最完全的纯度了。
硝酸是最易于化合同时也是极容易分解的物质之一。除了金、银和铂之外,几乎所有的简单物质都或少或多地掠取其氧;有些简单物质甚至将其全部分解。人们很早就知道它,化学家们对其化合物要比对其他任何酸的化合物都研究得多。这些化合物曾被马凯和博梅(Beaumé)二位先生称为硝石类;由之形成它们的有硝酸和亚硝酸之分,因而我们已将它们的名称改为硝酸盐和亚硝酸盐,并且增加了每个特定基的特有名称,以相互区分几种化合物。
硫酸与成盐基的化合物表
(以亲和力为序)
第十四节 对于硫酸及其化合物的观察
这种酸早已通过蒸馏由硫酸铁获得,在硫酸铁中,硫酸与氧化铁按照15世纪巴塞尔·瓦伦丁(Basil Valentine)所描述的过程化合;但在现代,它是通过在适当的器皿中燃烧硫更经济地获得的。既是为了促进燃烧,也是为了帮助硫的氧化,将一点点粉末状硝石盐,即硝酸草碱与之混合;硝石被分解,将其氧释放给硫,促使其转化为酸。尽管加了这,硫在封闭的器皿中持续燃烧仍只是有限的时间;化合终止了,因为氧耗尽了,而且器皿中的空气几乎还原成纯氮气,还因为酸本身始终处于蒸气状态,妨碍了燃烧的进行。
在大规模制造硫酸的工厂里,硝石和硫的混合物在衬有铅的大型密封室中燃烧,密封室底部有少量水以促使蒸气凝聚。然后,经用柔热在一个大曲颈甑中蒸馏,略含有酸的水便从上面通过,硫酸以浓缩状态留下来。它此时是澄清无味的,重量几乎是同体积水的两倍。用几套对着硫焰的手拉风箱将新鲜空气导入密封室,并让亚硝气经由长蛇形管排出,与水接触,吸收它可能含的任何硫酸气或亚硫酸气,就会使这个过程极容易进行,并使燃烧大大延长。
贝托莱先生由一个实验发现,69份硫在燃烧中与31份氧结合形成100份亚硫酸;他根据用不同方法所做的另一个实验计算出,100份硫酸由72份硫与28份氧化合而成,这全是以重量而论的。
这种酸与其他一切酸一样,只有当金属先前已经被氧化过时才溶解金属;但是,大多数金属能分解部分酸,以致夺走足够数量的氧,使它们本身可溶于尚未分解的部分酸中。银、汞、铁和锌在沸浓硫酸中便发生这种情况;它们首先被部分分解的酸氧化,然后溶解于其他部分;不过它们并不充分解除分解了的部分酸的氧化使其恢复为硫;它只被还原为亚硫酸状态,经加热而挥发,以亚硫酸气的形式飞掉。
银、汞以及除铁和锌以外的所有其他金属均不溶于稀硫酸,因为它们对氧不具有足够的亲和力,使其从它与硫酸、亚硫酸或者氢的化合物中脱除;但铁和锌受酸的作用之助,分解水,并靠消耗酸而被氧化,无须热的帮助。
亚硫酸与成盐基的化合物表
(以亲和力为序)
注 这些盐中,老的化学家们唯一知道的就是被称为施塔尔硫盐的亚硫酸草碱。因此,在我们的新命名法之前,这些具有固定植物碱基的化合物必定会被称为施塔尔硫盐,具有其他碱基的化合物也一样。
在此表中,我们采纳了伯格曼的硫酸亲和力次序,该次序相对于土质和碱类而论是相同的,但不能确定该次序对于金属氧化物是否仍相同。——A
第十五节 对于亚硫酸及其化合物的观察
亚硫酸是由氧与硫经比硫酸低的氧化度结合而形成的。无论是缓慢地燃烧硫,还是从银、锑、铅、汞或炭中蒸馏硫酸,皆可获得它;经这种操作,部分氧离开酸与这些可氧化基结合,酸则以亚硫氧化态从上面通过。这种酸在通常的空气压力和温度下只能以气体形式存在;但根据克卢埃(Clouet)先生的实验,它似乎在极低的温度下凝结成为流体。水吸收这种气体的量要比吸收碳酸气的量大得多,但却比它吸收的盐酸气少得多。
金属先前没有被氧化,否则为此在溶解时从酸中获得氧,就不能溶解于酸,这也许是我曾经常重复的一个一般的完全确立了的事实。因此,当亚硫酸已经失去形成硫酸所必须的大部分氧时,它就更倾向于重新获得氧,而不是把它提供给绝大部分金属;由于这个原因,它就不能使它们溶解,除非它们先前已用其他方法被氧化过。金属氧化物溶解于亚硫酸无泡腾且极容易,便是由于同一个原理。这种酸与盐酸一样,甚至具有溶解含过多氧且通常不溶于硫酸的金属氧化物的性质,并以这种方式形成真正的硫酸盐。因此,假若不是与铁、汞和某些其他金属的溶解伴随着的现象使我们确信这些金属物质在它们溶解于酸的过程中能有两个氧化度的话,我们也许就会得出结论认为不存在亚硫酸盐。因此,其中金属被氧化得最少的中性盐就必定被称为亚硫酸盐,而其中金属被氧化得充分的中性盐必定就叫做硫酸盐。尚不知道这种区分是否适用于除铁和汞的硫酸盐之外的金属硫酸盐。
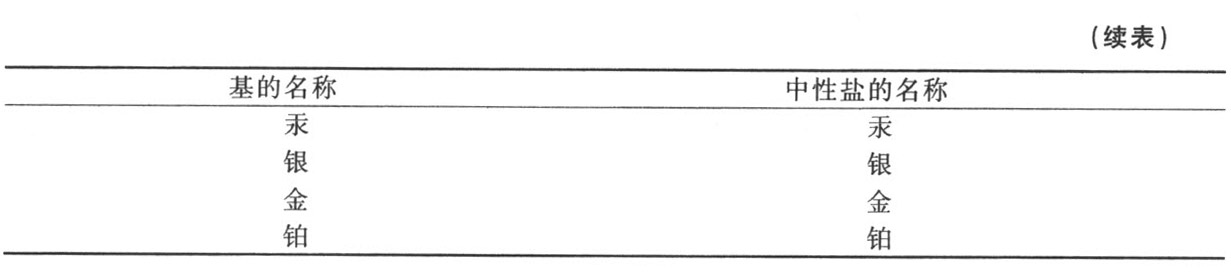
亚磷酸和磷酸与成盐基的化合物表
(为亲和力为序)

① 所有的亚磷酸盐直至最近才知道,因此尚无名称。——A
② 绝大部分磷酸盐只是近来才发现,尚未命名。——A
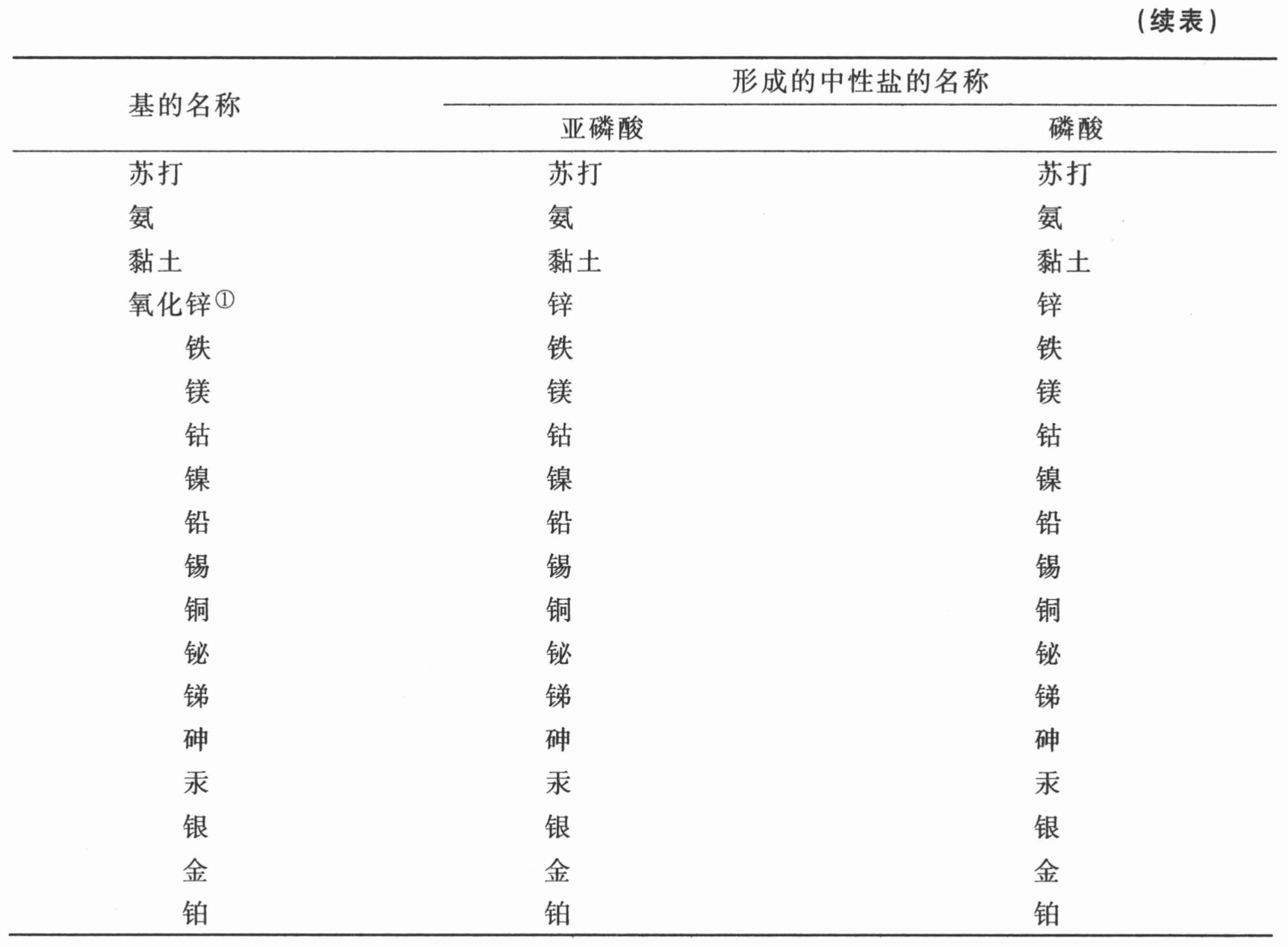
① 金属磷酸盐的存在必须先假定金属能在不同的氧化度溶解于磷酸,这一点尚未确定。——A
第十六节 对于亚磷酸和磷酸及其化合物的观察
在第二部分第九节即磷这一节,我们已经给出了这种奇特物质的发现史,以及对它在植物物体和动物物体中的存在方式的观察。获得处于纯态的这种酸的最好方法,就是在里面用蒸馏水弄湿了的玻璃钟罩之下燃烧充分纯化了的磷;它在燃烧过程中吸收它本身重量两倍半的氧;因此,100份磷酸由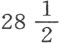 份磷与
份磷与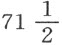 份氧结合而成。在汞上面的干燥玻璃钟罩中燃烧磷,可以得到凝结的这种酸,它取白片状,能贪婪地吸引空气中的水分。
份氧结合而成。在汞上面的干燥玻璃钟罩中燃烧磷,可以得到凝结的这种酸,它取白片状,能贪婪地吸引空气中的水分。
要得到磷在其中被氧化得比在磷酸状态少的亚磷酸,磷必须在插入了一个水晶管形瓶的玻璃漏斗上通过极其缓慢地自发燃烧;几天之后,便发现磷被氧化了,亚磷酸按其组成比例从空气中吸引了水分,滴进管形瓶中。亚磷酸长时间地暴露在大气中很容易变成磷酸;它从空气中吸收氧而被充分氧化。
由于磷对氧具有足够的亲和力,从硝酸和盐酸吸引它,因此我们可以用这些酸以非常简单和廉价的方式形成磷酸。将一个管状接受器半充满浓硝酸并柔和地加热之,然后向管中投入小片磷;它们伴着泡腾被溶解,亚硝气红雾则飞掉;只要磷将要溶解就再加磷,然后增加曲颈瓶下面的火,驱除最后的硝酸粒子;磷酸部分呈流体,部分呈凝结体,就留在了曲颈瓶中。
碳酸与成盐基的化合物表
(以亲和力为序)
① 由于这些盐只是近来才熟悉,严格地讲,它们并没有任何旧名称。莫维先生在《全书》第一卷中将它们称为毒盐(Mephites );伯格曼先生把它们称为充气的;德·佛克罗伊先生把碳酸称作白垩酸,把它们命名为白垩。——A
第十七节 对于碳酸及其化合物的观察
在所有的已知酸中,碳酸在自然界最丰富;它预先形成而存在于白垩、大理石以及一切石灰质石头之中,在这些石头之中,它被一种叫做石灰的特殊土质所中和。要从这种化合物中分离它,只需要加一些硫酸或者任何对石灰有更强亲和力的其他物质;接着便发生泡腾,这是由碳酸的离析产生的,碳酸一游离便立即呈气体状态。这种气体不能通过迄今所知的任何程度的冷却或压力凝聚成为固体或液体形式,它与约为其同体积的水结合因而形成一种极弱的酸。它也可以从发酵的糖质大量获得,但是它被它在溶液中所含的醇所污染。
由于炭是这种酸的根,我们可以通过在氧气中燃烧炭或者以适当的比例使炭与金属氧化物化合来形成它;氧化物中的氧与炭化合,形成碳酸气,游离的金属则恢复其金属或熔块形态。
感谢布莱克(Black)博士给了我们关于这种酸的最初知识,在他的时代之前,这种酸总是处于气体态的性质使它巧妙地逃避了化学的研究。
盐酸与成盐基的化合物表
(以亲和力为序)
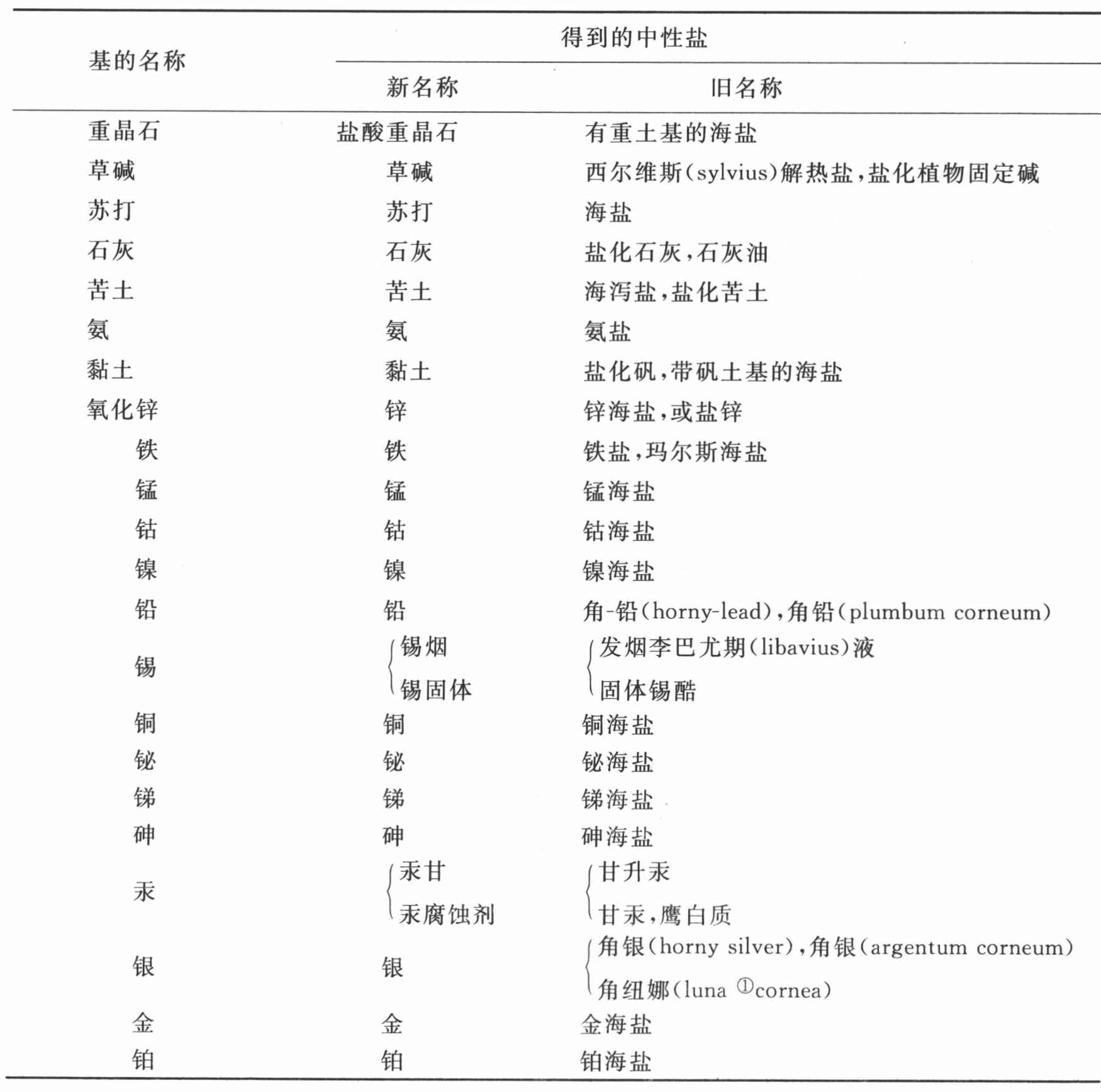
① 纽娜,罗马神话中的月神,西方炼金术用语中代表银。——C
假若我们能够用任何廉价的方法分解这种气体,那么这对于社会来说就是一个极有价值的发现,因为为了经济目的,我们用这种方法可以获得石灰质土、大理石、石灰石等等中所含的极为丰富的炭。这不能用单一的亲和力完成,因为要分解碳酸,就需要一种像炭本身那样的可燃物质,结果我们只能使一种可燃物体与另一种并不更有价值的物体交换;不过这也许可能用双重亲和力完成,因为这个过程非常容易地被自然界在由极普通的物质生长期间完成了。
氧化盐酸与成盐基的化合物表
(以亲和力为序)

注 盐的这种次序古代化学家完全不知道,是1786年贝托莱先生发现的。——A
第十八节 对于盐酸和氧化盐酸及其化合物的观察
盐酸在矿物界是非常丰富的,它与不同的成盐基,尤其是苏打、石灰和苦土自然化合着。在海水及一些湖的水中,它与这三种基化合,而在岩盐矿中,它多半与苏打结合。这种酸似乎迄今尚未在任何化学实验中被分解;因此我们还摸不清其根的本质是什么,只能根据与其他酸的类比断定,它含有氧作为其酸化要素。贝托莱先生怀疑该根具有金属的性质;不过,由于大自然似乎每天都在栖居场所通过将瘴气与气态流体化合,来形成这种酸,因此这就必然要假定某种金属气体存在于大气中,这当然不是不可能的,但没有证据不能得到承认。
盐酸对成盐基只有中等程度的黏附力,硫酸容易将它从它与这些基的化合物中驱除。其他的酸,例如硝酸,也可以符合同样的目的;但硝酸易挥发,蒸馏过程中会与盐酸混合。约一份硫酸就足以分解两份烧爆了的海盐。这个操作在一个管状曲颈瓶中完成,该曲颈瓶有与之适合的沃尔夫装置(图版IV,图1 )。当所有的接头都完全用封泥封住时,就通过管子将海盐放进曲颈瓶中,将硫酸倒在上面,迅速用打磨过的水晶塞子将瓶口塞住。由于盐酸在常温下只能以气体形式存在,因此没有水存在我们就不能使其凝聚。所以,要在沃尔夫装置中的瓶子里用水半装满;盐酸气从曲颈瓶中的海盐中驱除出来,并与水化合,形成老化学家们所谓的发烟盐精或格劳伯尔海盐精,我们现在将其称为盐酸。
由上述过程获得的酸,用氧化锰、氧化铅或氧化汞蒸馏,可以与更大剂量的氧化合,得到的酸我们将其称为氧化盐酸,它与前者一样,只能以气体形态存在,被水吸收的量少得多。当迫使水中所含的这种酸超过一定点时,过量的酸便以凝结形态沉入容器的底部。贝托莱先生曾指出,这种酸能与大量的成盐基化合;由这种结合所产生的中性盐能与炭和许多金属物质一起爆燃;这些爆燃十分剧烈和危险,这是由于氧所携带的大量热素成为氧化盐酸的组成成分所致。
硝化盐酸与成盐基的化合物表
(尽所知道的亲和力次序排列)

注 这些化合物的大部分,尤其是与土质和碱类的化合物,还没怎么检定,我们仍要弄清楚,它们是形成一种复合根仍处于化合状态的混合盐,还是两种酸各自形成两种不同的中性盐。——A
第十九节 对于硝化盐酸及其化合物的观察
硝化盐酸以前称为王水,它是由硝酸和盐酸的一种混合物形成的;这两种酸的根化合起来,形成一种复合基,由此产生一种酸,该酸具有它自身特有的、与其他一切酸的性质都不同的性质,尤其是溶解金和铂的性质。
金属在溶解于这种酸的过程中,与溶解于所有其他酸的过程中一样,首先吸引复合根的部分氧而被氧化。这就引起一种迄今尚未描述过的特殊气体的离析,说气体可以称为硝化盐气;它有十分令人讨厌的气味,如果被动物吸入则对其生命将是毁灭性的;它腐蚀铁使其生锈;它被水大量吸收,因此获得些微酸性特征。我有理由在对铂进行实验的过程中对这些特征发表意见,在此过程中我在硝化盐酸中溶解了大量的这种金属。
我起初曾怀疑,在硝酸和盐酸的混合物中,后者吸引了前者的部分氧而转化成为氧化盐酸,这就赋予它溶解金的性质;但是有几个事实靠这个猜想仍无法说明。假若如此,我们必定能通过加热这种酸离析出亚硝气,然而并未察觉到它的发生。根据这些考虑,就导致我采纳贝托莱先生的见解,认为硝化盐酸是一种单一的酸,它带有一个复合的基或根。
萤石酸与成盐基的化合物表
(以亲和力为序)


注 这些化合物老化学家们完全不知道,因此在旧的命名法中没有名称。——A
第二十节 对于萤石酸及其化合物的观察
萤石酸预先已在萤石(fluoric spars) (8) 中自然形成而存在,与石灰质土化合结果形成一种不溶的中性盐。为得到与该化合物离析的萤石酸,将萤石即萤石酸石灰放进一个盛有适量硫酸的铅质曲颈瓶中;配上一个也是铅质的接受器,半装满水,并用火加热曲颈瓶。由于硫酸具有较大的亲和力,它就将萤石酸驱除,萤石酸从上面通过,被接受器中的水所吸收。由于萤石酸在常温下自然处于气体状态,因此我们可以在一个汞气体化学装置中接收它。在此过程中我们必须使用金属器皿,因为萤石酸溶解玻璃和硅土,甚至使这些物体变成挥发性的,在蒸馏时将它们一起以气体形式带走。
我们感谢马格拉夫(Margraff)先生使我们首先认识到这种酸,尽管由于他从来没能获得不与大量的硅土化合的这种酸,因此不了解它是一种独特的酸。德·利安考特公爵(The Duke de Liancourt)以布兰杰(Boulanger)先生的名义大大增加了我关于其性质的知识;舍勒先生似乎已经彻底研究了这个主题。剩下来的唯一的事情,就是尽力发现萤石酸根的本质,我不能形成任何关于它的观念,因为该酸似乎在任何实验中都未被分解过。只有靠复合的亲和力,为此目的做的实验才有成功的概然性。
月石酸与成盐基的化合物表
(以亲和力为序)


注 这些化合物大部分老化学家们既不知道也未命名。月石酸以前称为镇静盐,它的带有固定植物碱基的复合物称为月石砂。——A
第二十一节 对于月石酸及其化合物的观察
这是一种由从印度获得的叫做月石砂(borax )或原月石砂(tincall )的盐提取的凝结酸。虽然人工使用月石砂已有很长时间,但我们到目前为止关于其起源及提取和纯化它的方法仍无十分完善的知识;有理由相信它就是在东方某些部分的土中和某些湖的水中发现的一种天然盐。全部月石砂贸易都在荷兰人的掌握之中,纯化它的技术被他们所独占,直到最近,巴黎的诸位勒吉利埃(L' Eguillier)先生才在此行业中与之匹敌;不过这种方法对世界而言仍是一个秘密。
通过化学分析,我们认识到月石砂是一种中性盐,它带有过量的基,由苏打组成,被一种长期称为荷伯格镇静盐,现在叫做月石酸的特殊酸所部分饱和。这种酸发现在某些湖的水中处于未化合状态。意大利彻恰约(Cherchiaio)的湖中每品脱水含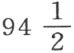 格令。
格令。
为了获得月石酸,将一些月石砂溶解于沸水之中,将此溶液过滤,加进硫酸或任何对苏打的亲和力比对月石酸的亲和力更大的其他物质;经冷却就离析出并获得处于晶态的这后一种酸。这种酸长期被认为是在获得它的过程中形成的,因此经这个过程它应当随将它与苏打分离开来时所使用的酸的本质的不同而不同;但是现在普遍承认,只要通过洗涤、反复溶解和结晶使之完全纯化不含其他酸的混合物,无论用什么方法获得,它都是同一种酸。它在水和醇中皆可溶解,并且具有把绿色传给该精的火焰的性质。这种情况曾使人们怀疑它含有铜,但这尚未被任何决定性的实验确证。相反,如果它含有这种金属,必定只能认为它是偶然的混合物。它以湿法与成盐基化合;虽然它不能以这种方式直接溶解任何金属,但用复合亲和力容易产生这种化合物。
上表以湿法亲和力为序提供了它的化合物;但是当我们用干法操作时,该次序就有重要变化;在这种情况下,黏土必须直接放在苏打之后,尽管它在我们的表中置于最末。
月石酸根迄今尚属未知;尚无实验能够分解该酸;根据与其他酸的类比,我们继定,氧化为酸化要素存在于其组成之中。
砷酸与成盐基的化合物表
(以亲和力为序)

注 盐的这种次序,古代化学家们完全不知道。马凯先生于1746年发现了砷酸与草碱和苏打的化合物,他把它们命名为砷的中性盐。——A
第二十二节 对于砷酸及其化合物的观察
在1746年《科学院文集》中,马凯先生指出,当白色氧化砷与硝石的一种混合物受强火作用时,便得到一种中性盐,他称之为中性砷盐。当时,一种金属起一种酸的作用这种奇特现象的原因,还完全不知道;但是,较现代的实验使人们认识到,在此过程中,砷夺走硝酸的氧而被氧化;这样,它就转化成为一种真正的酸,并与草碱化合。现在已知还有其他一些使砷氧化并得到它的游离于化合物的酸的方法。最简单和最有效的方法如下:用三份重量的盐酸溶解白色氧化砷;往处于沸腾状态的这种溶液中加进两份硝酸,蒸发至干燥。在此过程中,硝酸被分解,其氧与氧化砷结合转化成为酸,亚硝根以亚硝气状态飞掉;而盐酸则由于热而转化成为盐酸气,可收集于适当的容器之中。经在坩埚中加热直至变红,砷酸完全游离于该过程中所使用过的其他酸;剩下的就是纯凝结砷酸。
莫维先生在第戎(Dijon)的实验室中极成功地重复过的舍勒先生的方法如下:用黑氧化锰蒸馏盐酸;这就使它转化成为氧化盐酸;从锰夺走氧;用一个盛有白氧化砷的接受器将此接收,洒上少量蒸馏水;砷夺走氧化盐酸过饱和的氧而将其分解;砷转化成为砷酸,氧化盐酸恢复至普通盐酸状态。经蒸馏将两种酸离析,此操作至终均柔和加热;盐酸从上面通过,砷酸处于白色凝结形态。
砷酸的挥发性比白氧化砷小得多;由于它没有被充分氧化,常常含有溶解状态的白氧化砷,这通过像前一过程中那样继续加亚硝酸至不再有亚硝气产生来防止。由所有这些观察,我要给出砷酸的以下定义。它是由砷与氧化合的,在炽热中固定的,可溶于水,能与许多成盐基化合的一种白色凝固的金属酸。
第二十三节 对于钼酸及其与成盐基的化合物 (9) 的观察
钼是一种特殊的金属物体,能被氧化成为真正的凝固酸 (10) 。钼矿是该金属的一种天然硫化物,出于这个目的,将部分钼矿放进盛有五、六份硝酸的曲颈瓶中,硝酸用其重量的四分之一的水稀释,并对曲颈瓶加热;硝酸的氧既作用于钼又作用于硫,将一种转化成为钼酸,将另一种转化成为硫酸;只要有亚硝气红烟放出,就再倒上硝酸;钼就这样被尽可能地氧化了,而且发现它呈粉状留在曲颈瓶底部,与白奎相似。必须用温水将其洗涤,以使任何黏附的硫酸粒子分开;由于它几乎是不可溶的,所以在这种操作中损失极微。它与成盐基的一切化合物皆不为古代化学家所知。
钨酸与成盐基的化合物表

① 拉瓦锡先生以字母为序排列了与金属氧化物的化合物;由于不知道它们的亲和力次序,我将它们删略了,因为没有意义。——E
② 所有这些盐古代化学家都不知道。——A
第二十四节 对于钨酸及其化合物的观察
钨是一种特殊的金属,其矿常与锡矿相混淆。这种矿与水的比重为6比1;其结晶态类似于石榴石,颜色以灰白色到黄色和淡红各不相同;在萨克森(Saxony)和波希米亚(Bohemia)的几个地方发现了它。康沃尔矿(the mines of Cornwall)中常见的称为黑钨矿(Wolfram )的矿石,也是这种金属的矿石。在所有这些矿中,该金属都被氧化了;在某些矿中,它似乎甚至被氧化到酸的状态,与石灰化合成为一种真正的钨酸石灰。
为得到游离的酸,将一份钨矿与四份碳酸草碱混合,并将混合物在坩埚中熔化;再弄成粉末,倒上12份沸水,加上硝酸,钨酸就以凝固态沉淀出来。然后,为保证该金属的完全氧化,就再加硝酸,并蒸发至干,只要有亚硝气红烟产生就重复这种操作。要获得完全纯的钨酸,必须在一只铂坩埚中将该矿与碳酸草碱熔化,否则普通坩埚的土质就会与产物混合,并掺有该酸。
亚酒石酸与成盐基的化合物表
(以亲和力为序)

第二十五节 对于亚酒石酸及其化合物的观察
酒石,即固定在葡萄酒完成发酵的容器内部的凝结物,是一种熟知的盐,由一种特殊的酸过量地与草碱结合而成。舍勒先生首次指出了获得这种纯酸的方法。由于观察到它对石灰的亲和力比对草碱的亲和力大,因此他指引我们按以下方式着手。将纯酒石溶解于沸水中,加足量的石灰至酸被完全饱和。形成的亚酒石酸石灰由于几乎不溶于冷水,而落到底部,经倾析与草碱溶液分离开来;再用冷水将其洗涤并干燥之;倒上用八、九份水稀释了的硫酸,用柔热蒸煮十二小时,经常搅动混合物;硫酸与石灰化合,亚酒石酸便处于游离状态。在这个过程中,少量未经检验的气体被离析出来。在十二小时终了时,将清澈液倒出,用冷水洗涤硫酸石灰,将其加进清澈液中,然后蒸发,便得到凝结态的亚酒石酸。用八至十盎司硫酸,两磅纯化的酒石产生约十一盎司的亚酒石酸。
由于易燃根过量存在,即由于自酒石得到的酸未被氧充分饱和,因此我们将该酸叫做亚酒石酸(tartarous acid ),它与成盐基化合形成的中性盐叫做亚酒石酸盐(tartarites )。亚酒石酸的基是碳-亚氧或氢-亚碳根,其氧化的程度比在草酸中低;而且,根据哈森夫拉兹先生的实验,氮似乎以相当大的量成为亚酒石根的组成部分。通过氧化亚酒石酸,它可转化为草酸、苹果酸和亚醋酸;不过很可能是,根中的氢炭比例在这些转化过程中改变了,而且这些酸之间的差异不独在于不同的氧化度。
亚酒石酸在其与固定碱的化合物中可有两种饱和度;按其中的一种饱和度,用过量的酸形成一种盐,人们不恰当地将其叫做酒石乳(cream of tartar ),而按我们的新命名法,它被命名为微亚酒石酸草碱(acidulous tartarite of potash );按另一饱和度或等饱和度,形成一种完全中性的盐,以前叫做植物盐(vegetable salt ),我们将其命名为亚酒石草碱。这种酸与苏打形成亚酒石苏打,以前叫做塞涅特盐(sal de seinette ),即罗谢尔多用盐(sal pol ychrest of Rochell )。
第二十六节 对于苹果酸及其与成盐基的化合物的观察 (11)
苹果酸预先形成而存在于成熟和未成熟的苹果以及许多其他水果的酸汁之中,其获得方式如下:用草碱或苏打饱和苹果汁,加上适当比例的用水溶解了的亚醋酸铅;复分解便发生了;苹果酸与氧化铅化合并且由于几乎不溶解而沉淀,亚醋酸草碱或亚醋酸苏打则留在液体之中。用冷水洗涤倾析分离出来的苹果酸铅,并加进一些稀硫酸;硫酸与铅结合成为一种不溶的硫酸盐,苹果酸则以液体形态游离。
这种酸发现大量混有柠檬酸和亚酒石酸,是介于草酸和亚醋酸之间的一种酸,它比前者被氧化得更多而比后者被氧化得更少。根据这种情况,赫尔姆布塔特(Hermbstadt)先生称它为非完全醋(imper fect vinegar );但它又不同于亚醋酸,在其根的组成中有相当多的炭,有较少的氢。
如果在前述过程中用的是很稀的酸,则液体就既含苹果酸又含草酸,而且很可能还含一点亚酒石酸;将石灰水与酸、草酸盐、亚酒石酸盐相混合便把它们分离开来,并且产生苹果酸石灰;前二者是不溶的,便沉淀下来,苹果酸石灰则仍处于溶解状态;如以上指出的方式,先用亚醋酸铅,然后再用硫酸,便将纯苹果酸从液体中分离出来。
柠檬酸与成盐基的化合物表
(以亲和力 (12) 为序)
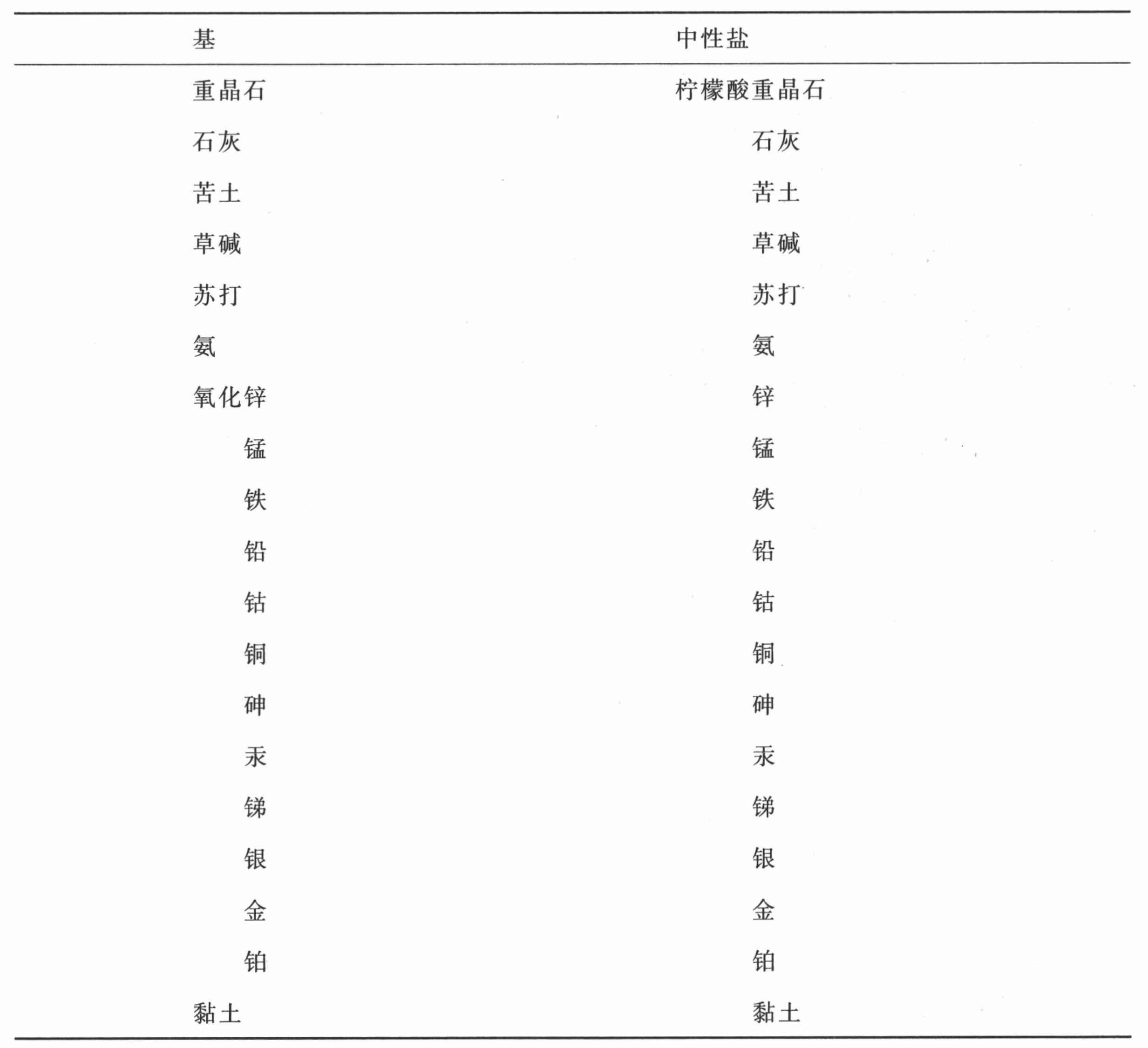
第二十七节 对于柠檬酸及其化合物的观察
柠檬酸通过榨挤柠檬获得,而且在许多其他水果汁中发现它与苹果酸混在一起。要得到纯的、浓缩的柠檬酸,首先要通过在冷藏地窖中长时间地静置除去水果的黏液部分,然后让其经过零下4或5度的温度,即从华氏21º到23º使其浓缩;水冻结了,而酸仍然是液体,体积减少至原来的八分之一。更低的冷度会使酸咬合于冰之中,致使其难以分离。这个方法是乔治乌斯(Georgius)先生指出的。
更容易地得到它,是用石灰饱和柠檬汁,结果形成不溶于水的柠檬酸石灰;洗涤这种盐,并倒上适量的硫酸;这就形成硫酸石灰,沉淀下来,使柠檬酸以液体形式游离。
焦亚木酸与成盐基的化合物表
(以亲和力 (13) 为序)
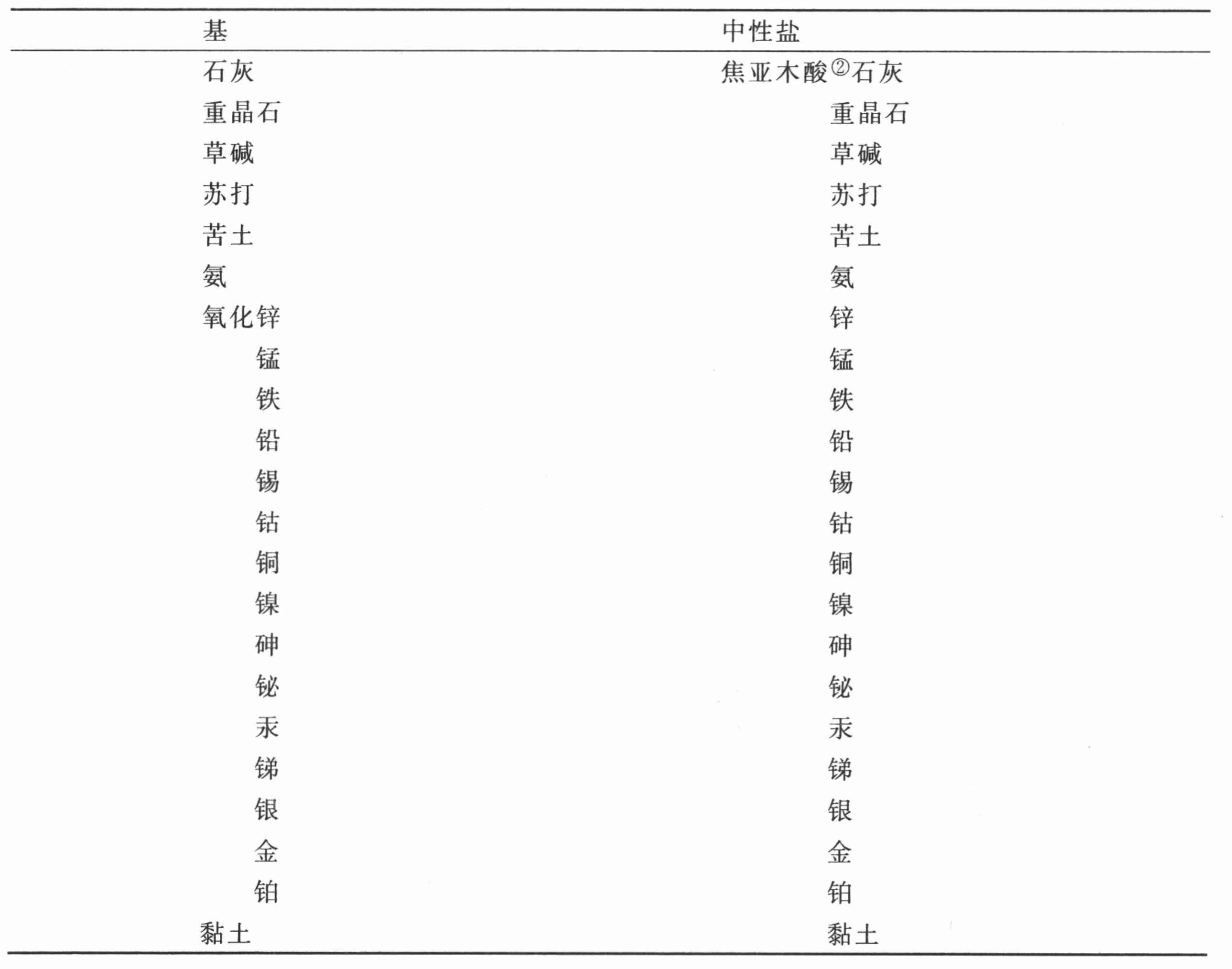
② 英文版误为“焦黏酸”。——C
第二十八节 对于焦亚木酸及其化合物的观察
古代化学家们观察到,大多数木头,尤其是较重和较致密的木头,经以露火蒸馏,放出一种特殊的酸精;但在戈特林(Geotling)先生1779年在克雷尔的《化学学报》(Chemical Journal )上说明他关于这个问题所做的实验之前,从来无人探究其本质和性质。无论从哪一种木头获得,这种酸都是相同的。第一次蒸馏时,它是褐色的,并且掺杂了较多的炭和油;经再次蒸馏它就从其中提纯出来。焦亚木酸根主要由氢和炭组成。
第二十九节 对于焦亚酒石酸及其与成盐基的化合物 (14) 的观察
焦亚酒石酸的名称是指通过用露火蒸馏从提纯了的酸性亚酒石酸草碱中获得的一种稀的焦臭酸。要得到它,让一个曲颈瓶半充满弄成了粉状的酒石,配一个带管的接受器,用一个弯管连通气体化学装置中的玻璃钟罩;逐渐使曲颈瓶下面的火加大,我们就得到混有油的焦亚酒石酸,用一只漏斗将其分离。蒸馏过程中有极大量的碳酸离析。用以上方法得到的酸被油大量污染,应当将其从中除去。某些作者建议通过再一次蒸馏来做这件事;但是第戎的院士们告诉我们,由于在此过程中发生爆炸,这种做法有极大的危险。
焦亚黏酸与成盐基的化合物 (15) 表
(以亲和力为序)


第三十节 对于焦亚黏酸及其化合物的观察
此酸经用露火蒸馏由糖和一切含糖物体获得;由于这些物质经火大大膨胀,所以必须让曲颈瓶的八分之七空着。它是黄色的,接近红色,它在皮肤上留下的痕迹去不掉,除非连表皮一起去掉。经再次蒸馏可以得到不怎么有色的焦亚黏酸,如对于柠檬酸所指出的那样,它经冷冻而浓缩。它主要由水和轻微氧化了的油组成,经用硝酸进一步氧化可转化成为草酸和苹果酸。
人们一直认为此酸在蒸馏过程中有大量气体离析,如果用柔热进行蒸馏,情况就不是这样。
草酸与成盐基的化合物表
(以亲和力为序 (16) )


第三十一节 对于草酸及其化合物的观察
草酸主要是在瑞士和德国由酸模(sorrel)榨出的汁制备的,经长时间静置,草酸从其中结晶出来;它在这种状态部分被草碱所饱和,形成一种真正的微酸性的草酸草碱,即由于酸的过剩形成的盐。要得到纯草酸,必须经人工氧化糖来形成,它似乎是真正的草酸根。往一份糖上倒六或八份硝酸并加柔热;发生相当大的泡腾,并有大量亚硝气离析;硝酸被分解,其氧与糖结合。让该液体处于静止状态,纯草酸结晶就形成了,必须将其置于吸墨水纸上使其干燥,以除去剩下的那部分硝酸;为保证该酸的纯度,将结晶溶于蒸馏水中再重新使其结晶。
由草酸第一次结晶之后所剩下的液体,我们可以通过冷冻获得苹果酸。此酸比草酸被氧化得更多;而且,经进一步氧化,糖可以转化成为亚醋酸,即醋。
与少量苏打或草碱化合了的草酸,与亚酒石酸一样,具有这样的性质,即未经分解而成为许多化合物的组成部分。这些化合物形成三元盐,即具有双基的中性盐,它们应当有恰当的名称。酸模的盐,即与过量草酸化合的草碱,在我们的新命名法中称为微草酸草碱(acidulous oxalate of potash)。
由酸模获得的酸为化学家们所知已有一个多世纪,这已由杜克洛(Duclos)先生在1688年的《科学院文集》中提及,而且波尔哈夫已颇精确地描述了这种酸;不过,是舍勒先生首次指出它含有草碱,并证明它与糖被氧化所形成的酸完全相同。
亚醋酸与成盐基的化合物表
(以亲和力为序排列)

第三十二节 对于亚醋酸及其化合物的观察
此酸由炭和氢组成,炭和氢结合在一起再加上氧便处于酸的状态;因此,它是由与亚酒石酸、草酸、柠檬酸、苹果酸等酸相同的元素形成的,不过这些元素按不同比例存在于这些酸中;亚醋酸(acetous acid)所处的氧化态似乎比其他这些醋高。我有理由相信,亚醋酸根所含氮的分量少;而且,由于除了亚酒石酸之外,任何植物酸根中均不含此元素,这种情况便是产生差异的原因之一。亚醋酸即醋,由葡萄酒经温热,加上某种酵素制得。酵素通常是残渣,即酵母,它由另外的发酵过程中的醋或者某种类似物质分离出来。葡萄酒的类酒精部分由炭和氢组成,被氧化转化成为醋。此过程只能在与空气自由接触的情况下才能发生,而且由于吸收氧的缘故总是伴随着使用的空气减少;因此,总是应当在只有半充满用来进行亚醋发酵的酒液的容器中进行。在此过程中形成的酸极易挥发,并且混有很大比例的水和杂质;要得到纯亚醋酸,得将其在石质或玻璃容器中用柔火蒸馏。蒸馏过程使这个过程中跑出的酸多少有所改变,它与留在蒸馏器中的酸不完全属于同一类,似乎被氧化得较低。这种情况以前从来没有被化学家们观察到。
蒸馏不足以使此酸丧失其全部不必要的水;为了这个目的,最好的办法是使其处于凝固点以下4º至6º的冷度,即华氏19º至23º;通过这种方式,水冻结了,剩下的便是处于液体状态并且相当浓的酸。在通常的气温下,此酸只能以气态存在,只能与很大比例的水化合而保持住。获得亚醋酸还有其他化学方法,这包括用硝酸氧化亚酒石酸、草酸及苹果酸;但是,有理由相信,根的元素比例在这些过程中发生了变化。哈森夫拉兹先生目前正在重复据说是由之产生这种转化的实验。
亚醋酸与各种成盐基的化合物极易于形成;但是得到的大多数中性盐不可结晶;而由亚酒后酸和草酸产生的中性盐一般则几乎是不溶的。亚酒石酸石灰和草酸石灰在任何可察觉的程度上都是不溶的。苹果酸盐在溶解度方面居于草酸盐和亚醋酸盐之间,苹果酸的饱和度处于草酸与亚醋酸之间,金属在溶解之前须用这种酸氧化,犹如须用其他酸氧化一样。
除了亚醋酸草碱、亚醋酸苏打、亚醋酸氨、亚醋酸铜和亚醋酸铅之外,古代化学家几乎不知道由亚醋酸与成盐基化合形成的任何盐。卡德(Cadet)先生发现了亚醋酸砷 (17) ;文泽尔(Wenzel)先生、第戎的院士们、德·拉索涅(de Lassone)先生和普鲁斯特(Proust)先生使我们知道了其他亚醋酸盐的性质。根据亚醋酸草碱所具有的性质,即在蒸馏中放出氨,有理由假定,除了炭和氢之外,亚醋酸根还含有小比例的氮,不过,上述氨的产生也许是由草碱分解所致,这并非不可能。
醋酸与成盐基的化合物表
(以亲和力为序)

注 所有这些盐古人皆不知道;甚至那些极专心地从事现代发现的化学家们也不知道,氧化醋酸根所产生的大部分盐严格说来是属于亚醋酸盐类,不是属于醋酸盐类。——A
第三十三节 对于醋酸及其与成盐基的化合物的观察
我们假定根醋(radical vinegar)由于与亚醋酸根相同但被氧饱和得程度更高的根所组成,由此已经将醋酸的名称赋予根醋。按照这个观念,醋酸是氢-亚碳根能够氧化的最高程度;不过,尽管这种情况极为概然,在它作为一个绝对的化学真理被采纳之前,还需要进一步的更多的决定性实验来确证。我们按如下方式获得此酸:往三份亚醋酸草碱或亚醋酸铜上倒一份浓硫酸,经蒸馏就得到极浓的酸,我们将其称为醋酸(acetic acid ),即以前所命名的根醋。既没严格证实这种酸的氧化程度比亚醋酸高,也没严格证实它们之间的差异也许不在于根或基的元素之间的不同比例。
琥珀酸与成盐基的化合物表
(以亲和力为序)
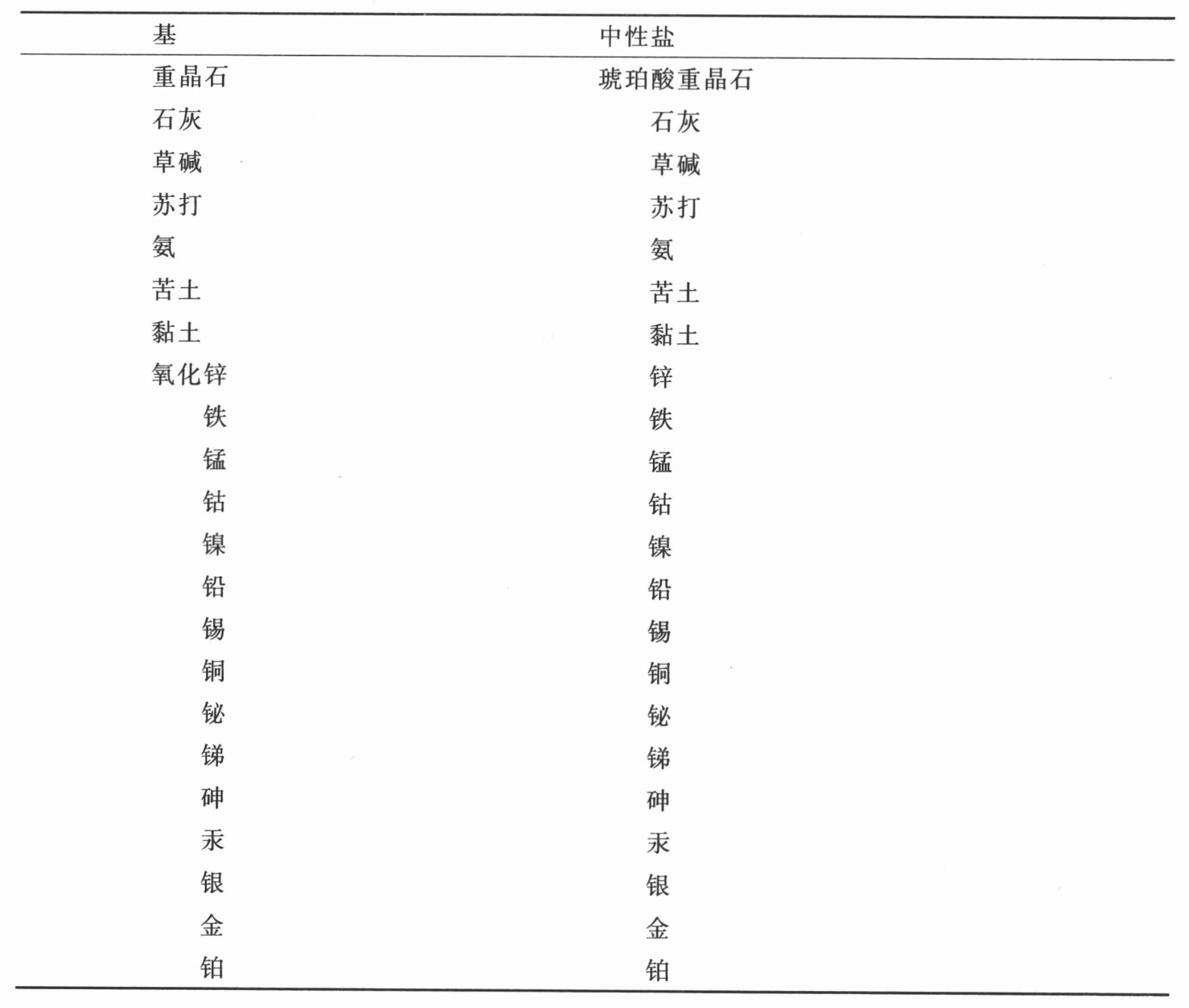
注 所有的琥珀酸盐皆不为古代化学家所知。——A
第三十四节 对于琥珀酸及其化合物的观察
琥珀酸由琥珀经温热升华并以凝结形式上升进入升华皿的皿颈处而获得。此操作不必过分或用过强的火,否则琥珀油就随酸一起上升。盐置于吸墨水纸上干燥并经反复溶解和结晶来提纯。
此酸溶于其自身重量二十四倍的冷水及量少得多的热水之中。它稍微具有一点酸的性质,只对蓝色植物颜料有轻微的影响。此酸与成盐基的亲和力取自德·莫维先生,他是第一个尽力确定这些亲和力的化学家。
第三十五节 对于安息香酸及其与成盐基的化合物 (18) 的观察
此酸以本杰明华或安息香华(Flowers of Benjamin or of Benzoin )的名称为古代化学家所知,由叫做安息香的树胶或树脂经升华而获得。获得它的方式,via humida (19) ,是乔弗罗瓦先生发现、舍勒先生完善的。弄碎成粉末的安息香上面倒上有过量石灰的强石灰水;不断搅拌混合物,蒸煮半小时之后,倒出液体,并只要出现中和就以同样方式使用新鲜的石灰水。不导致结晶就尽可能地使所有倾析的液体结合并蒸发,当液体冷却时滴入盐酸直至不再有沉淀形成。经此过程的前一部分形成安息香酸石灰,而经后一部分,盐酸与石灰化合形成盐酸石灰,盐酸石灰保持溶解状,而安息香酸由于不溶便以凝结状态沉淀。
第三十六节 对于樟脑酸及其与成盐基的化合物 (20) 的观察
樟脑是一种凝结的精油,由生长于中国和日本的一种月桂(laurus )经升华而得到。从樟脑中八次蒸馏出硝酸,科斯加顿(Kosegarten)先生将其转化成为一种类似于草酸的酸;但是由于它在某些情况下与该酸有差异,因此我们一直认为有必要给它一个特定的名称,直至进一步的实验更完满地确定了其本质为止。
由于樟脑是一种碳-亚氢或氢-亚碳根,容易相像,它经氧化当形成草酸、苹果酸及其他几种植物酸。由科斯加顿先生的实验提出这个猜想并非不可能;樟脑酸与成盐基的化合物中所显示的主要现象,非常类似于草酸和苹果酸与成盐基的化合物所显示的现象,这使我相信,它是由这两种酸的混合物组成的。
第三十七节 对于棓酸及其与成盐基的化合物 (21) 的观察
棓酸以前叫做涩素(principle of astringency ),是用水浸泡或煎熬,或者用柔热蒸馏,由棓子得到的。此酸只是在这几年才引起人们的注意。第戎科学院委员会已经研究了它的所有化合物并给出了迄今为止对该酸的最好的说明。其酸性极弱;它使石蕊颜料变红,使硫化物分解,在金属事先已被溶解于其他某种酸时它与这些金属结合。通过这种化合,铁呈深蓝或紫罗兰色沉淀下来。此酸的根,如果说应该有个名称的话,那么迄今尚不完全知道;它含于栎柳、沼鸢尾、草莓、睡莲、秘鲁树皮 (22) 、石榴花和石榴树皮以及其他许多木头和树皮之中。
第三十八节 对于乳酸及其与成盐基的化合物 (23) 的观察
我们关于这种酸的唯一准确的知识来自舍勒先生的著作。它含于乳清之中,与少量土质结合着,按如下办法得到它:通过蒸发使乳清减少至其体积的八分之一,经过滤分离出酪质;然后加上够与该酸化合那么多的石灰;再加草酸离析出石灰,草酸与之化合成为一种不溶的中性盐。经倾析分离出草酸石灰时,蒸发剩下的液体至蜂蜜的浓度;乳酸用醇溶解,醇不与奶糖和其他杂质结合;这些杂质经过滤从醇和酸中分离;蒸发或蒸馏掉醇,最后剩下的就是乳酸。
此酸与所有的成盐基结合,形成不结晶的盐;它似乎很像亚醋酸。
糖乳酸与成盐基的化合物表
(以亲和力为序)

注 这些皆不为古代化学家所知。——A
第三十九节 对于糖乳酸及其与成盐基的化合物的观察
通过蒸发,可以从乳清中提取一种糖,它在药学中早已为人所知,它很像从甘蔗中获得的糖。这种糖质像通常的酸一样,可以用硝酸氧化。为此目的,从中蒸馏出几份硝酸;让剩下的液体蒸发并凝固结晶,用这个办法获得的是草酸结晶;同时也得到一种极细的白色粉末凝结物,这就是舍勒发现的糖乳酸。它能与碱、氨、土质,甚至与金属化合。它对于后者的作用,除了它与它们形成难溶的盐这一点之外,迄今几乎还不知道。表中的亲和力次序取自伯格曼。
蚁酸与成盐基的化合物表
(以亲和力为序)

注 这些全部不为古代化学家所知。——A
第四十节 对于蚁酸及其化合物的观察
此酸是在上个世纪由萨米埃尔·菲希尔(Samuel Fisher)经蒸馏从蚁类中获得的。马格拉夫于1749年,莱比锡的阿德维森(Ardwisson)和奥克恩(Ochrn)两位先生于1777年分别论述了这个问题。蚁酸是从大型红蚁种formica rufa,Lin. (24) 提取的,该蚁在树木茂密的地方形成蚁冢。获得它要么是用柔热蒸馏玻璃曲颈瓶或蒸馏器中的蚁类;要么是在用冷水洗涤蚁类并将其在布上弄干之后,泼上沸水,沸水溶解此酸;此酸也可以通过轻轻榨挤这种昆虫而获得,这种方法比前述两种方法都好一些。要得到纯蚁酸,我们必须精馏,通过蒸馏将它从未化合的油质和炭化物质中分离开来;它可以按处理亚醋酸的方式,通过冷冻而浓缩。
第四十一节 对于蚕酸及其与成盐基的化合物 (25) 的观察
当蚕从幼蚕变成蚕蛹时,这种昆虫的体液似乎呈现某种酸的特性。当它由蚕蛹变成蚕蛾时,它放出使蓝纸变红的微红色液体,第一个留心观察的是第戎科学院的肖西埃(Chaussier)先生,他将蚕蛾浸泡于醇之中,醇溶解蚕蛾的酸而不带有这种昆虫的任何胶质部分;蒸发掉醇,剩下的酸尚纯。此酸的性质和亲和力迄今尚未精确确定;我们有理由相信,从其他昆虫可以获得类似的酸。此酸的根自然如其他来自动物界的酸一样,是由炭、氢和氮,也许还加上磷组成的。
皮脂酸与成盐基的化合物表
(以亲和力为序)

注 所有这些皆不为古代化学家所知。——A
第四十二节 对于皮脂酸及其化合物的观察
为得到皮脂酸,把一些板油与一些细粉状生石灰一起放进长柄支脚小煮锅中,置于火上熔化,不断搅拌,升火至操作结束,注意防止令人作呕的蒸气。经此过程,皮脂酸与石灰结合成为皮脂酸石灰,它难溶于水;然而,将与脂质混合的皮脂酸石灰溶解于大量的沸水之中,它就与脂质分离。此中性盐经蒸发便由此分离出来;要使之变纯,则将其煅烧、再溶解并再次结晶。此后,我们倒上适量的硫酸,皮脂酸经蒸馏就出来了。
第四十三节 对于石酸及其与成盐基的化合物 (26) 的观察
根据伯格曼和舍勒新近的实验,尿结石似乎是一种带有某种土质成分的盐;它有微弱的酸性,需要大量的水溶解,一千格令沸水中只溶三格令,而且冷却时大部分再次结晶。这种凝固的酸,德·莫维称之为结石酸(lithiasia acid ),我们将其命名为石酸(bithic acid ),其本质和性质尚不知道。看来它是一种微酸性的中性盐,即过理地与某种成盐基化合的酸;我有理由相信,它实际上是一种微酸性的磷酸石灰;如果是这样的话,它必定就被排除在特殊的酸类之外了。
氰酸及其与成盐基的化合物表
(以亲和力为序)


注 所有这些皆不为以前的化学家所知。——A
第四十四节 对于氰酸及其化合物的观察
由于迄今对于此酸所做的实验关于其本质仍然留下了相当大的不确定度,我将不详述其性质以及使其变纯和从化合物中离析的方式。它与铁化合,使其染上蓝色,并且同样能与大多数其他金属化合,由于较大亲和力的缘故,碱、氨和石灰使这些金属脱离化合物而沉淀出来。根据舍勒的实验,尤其是根据贝托莱先生的实验,氰酸根似乎由炭和氮组成;因此,它是具有一个双基的酸。已经发现磷与之化合了,根据哈森夫拉兹先生的实验,磷似乎只是偶然的东西。
虽然此酸以与其他酸相同的方式,与碱、土质和金属化合,但它却只具有我们一直习惯于认为是酸所具有的性质中的某些性质,所以,这里把它归入酸类也许是不适当的;不过,按我已有的观察,直到用较大量的实验进一步阐明这个问题为止,关于这种物质的本质是难以形成一个明确的意见的。

拉瓦锡

油画《炼金术士》
人们对火和燃烧现象的实践已经由来已久。在17世纪以前,与化学有关的研究分散于炼金术和医药化学之中,没有形成统一的研究对象。而且有关化学的知识都处于经验阶段,炼金术士们虽然已经积累了许多孤立的事实,但是他们却未能发现涉及这些事实的理论。

在炼金术的研究中,常用的分析方法是“干法”,炼金术士们频繁地利用烈火,所以在他们的实验室里,最常见的就是炼金炉。而到了拉瓦锡时代,“湿法”已经胜过“干法”,化学家们不再频繁地求助于熔化。

17世纪的巴黎,人们常常把化学实验展示当成一种魔法表演。
17世纪之后,化学研究取得了重要的进展,但在拉瓦锡建立新理论之前,化学由燃素理论统治着。

1669年,德国著名化学家贝歇尔(Johann Joachim Becher,1635—1682)在《土质物理》一书中,对燃烧现象作了系统的研究。他认为燃烧是一种分解反应。

1731年,贝歇尔的学生施塔尔(Georg Ernst Stahl,1660—1734)继承了他的理论,并提出了燃素理论。他认为,物质在空气中燃烧是物质失去燃素,同时空气得到燃素的过程。

燃素理论可以解释一些现象,因此很多化学家(包括普里斯特利和舍勒等人)都拥护这一学说。图为瑞典著名化学家舍勒(Carl Wilhelm Scheele,1742—1786)。

普里斯特利(Joseph Priestley,1733—1804),英国著名化学家和牧师。他是笃信燃素理论的典型代表,总是用燃素理论来解释自己的研究成果

图为普里斯特利在伯明翰的房子和实验室,他在这里进行了分解氧化汞的“历史性”实验。虽然当时普里斯特利意识到该实验产生了一种新的气体,但是他却认定这是一种“脱燃素气体”。后来拉瓦锡也用氧化汞进行着同样的实验,发现了氧气。所以,法国著名生物学家居维叶(Georges Cuvier,1769—1832)说:“普里斯特利是现代化学之父,但是,他始终不承认自己的亲生‘女儿’。”

图为化学家在巴黎的皇家植物园演示化学实验。17世纪的人们喜欢到现场观看这种神奇的化学实验,尤其是鲁埃尔的展示更为受欢迎。拉瓦锡早年正是从鲁埃尔这里接受了对燃素理论的怀疑。
燃素理论是化学发展过程中不可超越的阶段,是人类对化学运动形式认识长链中的一个环节,它对化学的发展曾起过值得肯定的历史作用,但是它始终难以解释金属燃烧之后变重这个问题。

英国著名化学家波义耳(Robert Boyle,1627—1691)发现金属在空气中焙烧时,其重量会增加。早在1673年,他在著作中就描述了这一事实。

英国医生梅酋(John Mayow,1641—1679)也研究了燃烧现象。他和波义耳一样,也提出过很多见解,但他们的定量实验研究还不够系统,提出的见解只能说明某类燃烧或煅烧现象。

拉瓦锡为了验证物质燃烧后增重的事实,进行了著名的“钟罩实验”:把磷放在一个钟状的容器里燃烧,并证明了物质燃烧后的增重是因为与空气结合了,这一观点是与燃素理论完全对立的。
当普里斯特利还沉睡在燃素理论的怀抱中时,拉瓦锡的新研究思想已经形成,他以后的工作,正是在这一新思想指导下完成的。他否定了燃素的存在,认为燃烧是一种化合过程。氧的发现标志着拉瓦锡“氧化理论”真正确立起来了。

拉瓦锡1789年在巴黎出版的《化学基础论》(Traité Elémentaire de Chimie ),是第一部真正意义上的化学教科书。拉瓦锡在这部书中成功地将很多实验结果通过自己的氧化理论进行了圆满的解释,很快产生了巨大的轰动效应,被列入化学史上划时代的作品。在这本富有创造力的教科书中,约三分之一的篇幅为“化学仪器与操作说明”,可见拉瓦锡对这项工作的专注程度。图为拉瓦锡使用的气量计,现藏于巴黎国家工艺博物院国家技术陈列馆:(丁弘女士1994年拍摄)

图为拉瓦锡使用过的各种实验仪器,如天平、防护面罩等,现藏于巴黎国家工艺博物院国家技术陈列馆。

贝托莱和拉瓦锡在实验室中。
贝托莱(Claude Louis Berthollet,1748—1822)是拉瓦锡的亲密研究伙伴,和拉瓦锡共同制定了沿用至今的化学命名法。在此之前炼金术书中的“宇宙物质谱系”始终保留着一种神秘的气氛,常常使用隐讳的符号和名称。拉瓦锡使用化学语言来代替炼金术中的符号和名称,使人人都能看懂。

拉瓦锡正在给当时法国著名的科学家们解释空气的分析实验。图中人物从左至右分别为:维克达齐(F lix Vicq d'Azyr,1748—1794),居顿(Guyton,1737—1816,蒙日(Monge,1746—1818),贝托莱,拉普拉斯(Laplace,1749—1827),拉马克(Lamarck,1744—1829),拉格朗日,孔多塞(Condorcet,1743—1794),拉瓦锡。
lix Vicq d'Azyr,1748—1794),居顿(Guyton,1737—1816,蒙日(Monge,1746—1818),贝托莱,拉普拉斯(Laplace,1749—1827),拉马克(Lamarck,1744—1829),拉格朗日,孔多塞(Condorcet,1743—1794),拉瓦锡。

图为拉瓦锡进行的水的分解实验:水蒸气从左边的曲径瓶中逸出,进入用陶瓷密封的管道继续受热,分解得到的氢气,用右边的试管收集起来。

拉瓦锡正在演示“空气的成分”实验。

图为拉瓦锡的量热计(仿制品)。拉瓦锡认为动物的呼吸作用是一种氧化过程,断定小鼠体中的热来自氧化。他和拉普拉斯共同进行了这项研究:小鼠被放在中央室里,从它身体发出的热量使其周围的冰融化;测量冰块的融化得出呼吸放出的热量,同时还能测量小鼠呼出的二氧化碳的量。

很多重要的实验并非是拉瓦锡第一个进行的,只是他比别人走得更远。拉瓦锡将诸如卡文迪什、布莱克和普里斯特利等化学家的实验工作集中到一起,将他们的结果放到氧化理论的框架中,使化学向前发展到一个全新的水平。

拉瓦锡有着强大的工作能力,他承担了科学院的许多工作,如统一法国的度量衡:建立米制系统、制定质量标准。正如拉瓦锡预测的那样,统一度量衡不但有利于科学研究,而且促进了商业中货物的公平买卖。
拉瓦锡的氧化理论推翻了统治化学百年之久的燃素理论,这一智识壮举被公认为历史上最自觉的科学革命。它扫清了化学发展的障碍,奠定了现代化学的基础,指明了化学研究的方向和任务。自此以后,原子论、电化学、早期有机结构化学等一系列新理论、新发现接踵而至,使化学一跃成为19世纪的带头学科。如今,人们以各种各样的方式纪念这位伟大的化学家:修建博物馆、树立雕像、设立拉瓦锡奖章等。

图为位于德国慕尼黑Deutsches博物馆里的拉瓦锡实验室复原模型。

拉瓦锡雕像

国际生物热量学会(ISBC)为纪念拉瓦锡在热量测定方面作出的贡献而设置的“拉瓦锡奖章”。左图为奖章正面,其上有拉瓦锡的头像;右图为奖章的背面,上面刻有著名的拉瓦锡量热计。

印有拉瓦锡头像的银质奖章

1994年5月3日,在纪念拉瓦锡逝世200周年国际学术讨论会的招待会上,本书译者任定成与法国科学院副院长克洛德·傅雷雅克(Claude Fréjacque,1924—1994)在巴黎市政厅合影,两人手中的书是任定成翻译的拉瓦锡《化学基础论》中译本第一版。
————————————————————
(1) 见《科学院文集》1776年第671页以及1778年第535页。——A
(2) 关于这个问题,参见第一部分第十一章。——A
(3) 关于根据两种成分的比例应用这些名称,见第一部分第十一章。——A
(4) 英译本中将其误拼为Promotheus。——C
(5) 关于这个问题,见第一部分第十二章。——A
(6) 希望了解德·莫维、贝托莱、德·佛克罗伊诸位先生以及我本人关于这个重大的化学问题所说的东西的人士,可以查阅我们翻译的柯万先生的《论燃素》(Essay upon phlogiston ).——A
(7) 通过浸滤几份孟加拉天然泥土和几份俄属乌克兰天然泥土也大量获得硝石。——E
(8) 通常称为derbysbire spars(萤石)。——E
(9) 我没有补加这些化合物的表,因为它们的亲和力次序全属未知;它们称作钼酸黏土、钼酸锑、钼酸草碱,等等。——E
(10) 此酸是舍勒先生发现的,化学感谢他发现了其他几种酸。——A
(11) 我删略了表,因为亲和力次序不知道,拉瓦锡先生是以字母为序排列的。苹果酸与成盐基的一切化合物都称为苹果酸盐(malats ),皆不为古代化学家们所知。——E
(12) 这些化合物古代化学家并不知道。成盐基与这种酸的亲和力次序是伯格曼先生及第戎科学院的德·布雷内(de Breney)先生确定的。——A
(13) 上述亲和力是德·莫维和埃洛斯·布尔菲叶·德·克莱沃(Elos Bourfier de Clervaux)两位先生确定的。这些化合物直到最近才完全知道。——A
(14) 成盐基与此酸的亲和力次序迄今尚不知道。拉瓦锡先生它与焦亚木酸的相似性,猜想二者的亲和力相同;但是,这并未被实验所确定,故表被删略了。所有这些化合物都称为焦亚酒石酸盐,直到不久前才知道。——E
(15) 所有这些化合物都不为古化学家们所知。——A
(16) 全都不为古代化学家们所知。——A
(17) 《外国学者》(Savans Etrangers ),第三卷。
(18) 这些化合物叫做安息香酸石灰、安息香酸草碱、安息香酸锌等等;但是,由于不知道亲和力次序,以字母为序的表就删略了,因为不必要。——E
(19) 拉丁文,意为“湿法”。——C
(20) 这些化合物叫做樟脑酸盐,全都不为古人所知。表被删略了,因为是以字母为序列的。——E
(21) 这些化合物叫做棓酸盐,均不为古人所知;其亲和力次序尚未确定。——A
(22) 即金鸡纳皮。——C
(23) 这些化合物叫做乳酸盐;它们全都不为古代化学家所知,其亲和力尚未确定。——A
(24) 拉丁文,意为“大红蚁”。——C
(25) 这些化合物称为蚕酸盐,不为古代化学家所知;成盐基与蚕酸的亲和力尚未确定。——A
(26) 此酸原来只是一种,它的所有这些化合物皆不为古代化学家所知,该酸与成盐基的亲和力尚未确定。——A
