第八章 论燃烧与爆燃操作
第一节 燃烧通论
根据我在本书第一部分已经说过的,燃烧就是由可燃物体引起的氧气的分解。形成这种气体的基的氧被燃烧物体吸收并与之化合,同时游离出热素和光。因此,每一种燃烧必定都意味着氧化;相反,并非每一种氧化必定都意味着伴有燃烧;因为严格地说来,所谓燃烧没有热素和光的离析就不能发生。在燃烧能够发生之前,氧气的基对可燃物体的亲和力必定应当比它对热素的亲和力大;用伯格曼的措词就是,这种有择吸引只能在一定的温度上发生,此温度因每种可燃物质而异;因此,通过靠近加热了的物体引起第一运动或开始每一种燃烧是必要的。加热我们打算燃烧的任何物体的必要性依赖于某些考虑,这些考虑迄今尚未引起任何自然哲学家的注意,由于这个原因,我将在这个地方稍微详细地论述这个主题。
自然界目前处于平衡状态,这种平衡状态直至在通常的温度下可能的自发燃烧或氧化得以发生才能达到。因此,不打破这种平衡并把可燃物质升至较高的温度,新的燃烧或氧化就不能发生。要用例子说明关于这个问题的抽象观念:让我们假定地球的常温有一点变化,假定它只升高至沸水的程度;显然,在这种情况中,在低得多的温度中可以燃烧的磷,就不再会以其纯粹和简单状态存在于自然界之中,而总是会处于其酸态或氧化态,其根就会成为不为化学所知的一种物质了。通过逐渐升高地球的温度,一切能够燃烧的物体都会相继发生同样的情况;最后,每一种可能的燃烧都发生,无论任何可燃物体都不再会存在,因为每一种可受这种操作影响的物质都会被氧化,因此也就是不可燃烧的了。
因此,就与我们有关而言,除了在地球的常温中不可燃烧的物体之外,不可能存在任何可燃物体;换言之也一样,即,每种可燃物体如果不加热,即如果不将其升高到自然发生燃烧的温度,就必须不具有燃烧性质。一旦引起这个温度,燃烧就开始,而且由于氧气分解而离析出的热素就维持持续燃烧所必需的温度。当情况不是这样时,即当离析的热素不足以维持必需的温度时,燃烧就停息了。用普通语言表达这种情况,就是说物体烧得不完全或者很困难。
尽管燃烧与蒸馏,尤其是与复合的这种操作,具有某些共同的情况,但它们在非常实质性的一点上却不同。在蒸馏中有物质的部分元素彼此分离,并且在蒸馏过程中温度升高时发生的亲和力使这些元素以一种新的次序化合。这也发生于燃烧之中,但是却有进一步的情况,即物体中原本没有的一种新元素发生作用;氧加给了被操作的物质,热素则被离析了。
在伴有燃烧的所有实验中必须使用气体状态的氧以及必须严格确定所使用的量,使这种操作变得特别麻烦。由于几乎所有燃烧产物都以气体状态离析,保留它们甚至比保留复合蒸馏过程中所提供的气体更为困难;因此,这种预防措施就被古代化学家们完全忽视了;这种实验设备就独属现代化学了。
由于已经以一般方式指出了在燃烧实验中要考虑到的目的,因此,在本章以下各节中,我开始描述我为此目的所使用过的不同仪器。以下安排不是根据可燃物体的类别而是根据燃烧所必需的仪器的类别而形成的。
第二节 论磷燃烧
在我们着手的那些燃烧之中,在水装置(图版V,图1 )中将至少能容六品脱的广口瓶盛满氧气;当广口瓶完全盛满,以致气体开始从下面涌出时,将广口瓶A移往汞装置(图版IV,图3 )。然后我们用吸墨水纸把广口瓶内外的汞面弄干,在把纸插到广口瓶下面之前小心将纸浸入汞中保持一些时间,以免让普通空气进去,普通空气非常顽强地粘在纸的表面。首先把要用来燃烧的物体放在精密的秤中极精确地称量,然而将其放入铁质或瓷质小浅底盘D中;用一个大杯子P将此盖住,大杯子起分割钟罩的作用,再把整个通过汞放进广口瓶中,此后将大杯子撤掉。以这种方式使燃烧材料通过汞的困难,要以通过将广口瓶A的某一边升高一下,尽可能迅速地把可燃物体塞进小杯D来避免。在这种操作方式中,少量普通空气进入广口瓶,不过这无足轻重,在任何可以察觉的程度上既无损于实验的进行又无损于实验的精确性。
当D杯放入广口瓶之下时,我们吸出一部分氧气,以使汞升至EF处,如前面第一部分第五章中所指出的那样;否则,当燃烧物体着火时,膨胀的气体就会被部分压出去,我们就不再能够对实验前后的量做任何精确的计算。极方便的吸出空气的方式,是靠配有虹吸管GHI的气泵注射器,用此注射器可以使汞上升到二十八时以下的任何高度。极易燃的物体如磷,用炽热的弯铁丝MN(图版IV,图16 )快速通过汞来点火。不易点燃的物体则用一点引火物,引火物上固定有微小的磷粒子,磷在用炽热铁丝点火之前就放在要点火的物体上。
在燃烧的最初瞬间,受热了的空气变稀薄,汞下降;但是,当在磷和铁燃烧过程中不形成弹性流体时,不久吸收就十分明显,汞就上升进入广口瓶中。必须十分注意在一定量的气体中燃烧的任何物质的量都不可以太大,否则,在接近实验终了时,杯子就会离广口瓶很近,以致由于产生的强热及冷汞引起的突然冷却使其受破裂之危。关于测量气体体积的方法,以及根据气压计和温度计等等校正量具的方法,见这一部分第二章的第五和第六节。
上述方法极适合燃烧所有的固结物质甚至固定油。后者在广口瓶之下的灯中燃烧,用引火物、磷和热铁易于点着。但是,对于诸如醚、醇和精油之类的易蒸发物质来说,这是危险的;这些物质大量溶解于氧气之中;一着火,就发生危险而突然的爆炸,把广口瓶抛得很高,将其击成无数碎片。科学院的一些成员和我本人有两次险些挨炸。此外,虽然这种操作方式足以相当精确地确定被吸收的氧气量和产生的碳酸量,但是,由于对含有过量氢的植物物质和动物物质所做的一切实验中还形成了水,因此这套装置既不能收集水也不能确定水的量。用磷做的实验甚至是不完善的,因为不可能证实产生的磷酸重量等于燃烧的磷重量与此过程中吸收的氧气重量之和。因此,我不得已根据情况改变了仪器,并且使用了几种不同的仪器,我将从用来燃烧磷的仪器开始,按次序描述这些不同的仪器。
取一个大水晶或白玻璃球形瓶A(图版IV,图4 ),球形瓶有一个直径约为二吋半或三吋的瓶口EF,用金刚砂给瓶口精确地配上一个黄铜帽,黄铜帽有两个让管子xxx 和yyy 通过的孔。在用盖子关闭球形瓶之前,将支座BC放入其内,支座上放上盛有磷的瓷杯。然后用粘封泥封上瓶帽,让其干燥数日,精确称量;此后,用与管子xxx 相连的空气泵抽空球形瓶中的空气,通过管子yyy 从这一部分第二章第二节所描绘的气量计(图版VIII,图1 )将其充满氧气。然后用取火镜将磷点着,让其燃烧,直至固结的磷酸云使燃烧中止,同时不断由气量计提供氧气。装置已经冷却时称重并打开泥封;扣除仪器的皮重,剩下的就是所盛磷酸的重量。为了更加精确,检验燃烧之后球形瓶中所盛空气或气体是适当的,因为也许它碰巧稍重或稍轻于普通空气;在关于实验结果的计算中必须考虑这种重量之差。
第三节 论炭燃烧
我用于此过程所使用的装置由一个小圆锥锻铜炉组成,如图版XII图9 透视图所绘,其内部如图11 所示。它分为燃烧炭的炉体ABC、炉箅de 和灰孔F;炉子拱顶中间的管子GH用来导入炭,并用作放出燃烧用过了的空气的烟筒。通过与气量计相通的管子lmn ,把打算用来维持燃烧的氢气或空气送进灰孔F ,通过对气量计施加压力,由灰孔迫使氢气或空气通过炉箅de ,吹到直接放于其上的燃烧的炭上。
在与炭的燃烧过程中,占大气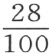 的氧气变成碳酸气,而氮气则根本不发生变化。因此,炭在大气中燃烧之后,必定留下了碳酸气和氮气的混合物;为了让此混合物通过,在G处用一个螺旋给烟筒GH配上管子op ,把气体输送进半盛满苛性草碱溶液的瓶子之中。碳酸气被碱吸收,氮气输送进第二个气量计,在此气量计中确定其量。
的氧气变成碳酸气,而氮气则根本不发生变化。因此,炭在大气中燃烧之后,必定留下了碳酸气和氮气的混合物;为了让此混合物通过,在G处用一个螺旋给烟筒GH配上管子op ,把气体输送进半盛满苛性草碱溶液的瓶子之中。碳酸气被碱吸收,氮气输送进第二个气量计,在此气量计中确定其量。
首先精确确定炉子ABC的重量;然后通过烟筒GH将已知重量的管子RS插进去使其下端搁在炉箅de 上,下端完全占据炉箅;接下来将炉子装满炭,再将整个装置加以称量以知道用来做实验的炭的精确量。于是将炉子放就位,把管子lmn 拧紧与气量计连通,把管子op 拧紧与碱溶液瓶子连通。一切准备就绪,打开气量计活塞,把一小块燃烧的炭投进管子RS,立即将此管撤掉,把管子op 拧到GH上。小炭块落至炉箅上,以这种方式到达所有炭的下面,通过来自气量计的空气流保持着火状态。为确信燃烧开始和完全继续,把管子grs 安装到炉子上,此管上端s 粘接有一片玻璃,通过它我们可以看见炭是否着火。
上面我忘了说炉子及其附件放在池子TVXY(图版XII,图11 )中的水中,必要时可以加冰起缓和热的作用;不过,此热并不是很强,因为除了来自气量计的空气之外并无任何其他空气,而且至多只是直接在炉箅上的炭同时在燃烧。
一块炭烧完时,由于炉壁倾斜的缘故另一块炭就落入其位置中;此炭进入来自炉箅de的空气流之中并且燃烧;依此相继,直至全部炭都燃尽。供燃烧之用的空气通过炭块,受气量计之压通过管子op逸出,再通过碱溶液瓶子。
这个实验提供了大气和炭的完全分析所必需的全部数据。我们知道消耗了的炭的重量;气量计给我们度量了所用的空气;燃烧之后所剩下的气体的量和质可以确定,因为它要么被接收在另一个气量计中,要么被接收在气体化学装置中的广口瓶中;留在灰孔中的灰量容易确定;量后,碱溶液瓶子所得到的增加的重量就给出了这个过程中所形成的碳酸的确切量。用这个实验,我们还可以足够精确地确定炭和氧以何种比例成为碳酸的组成部分。
在将来的一篇论文中,我将向科学院说明我用仪器对所有植物炭和动物炭所做过的一系列实验。通过极微略的改动,就可以使这台机器用来观察主要的呼吸现象。
第四节 论油燃烧
油就其本质而言与炭相比是较为复合的,它们至少由炭和氢这两种元素化合而成;当然,它们在普通空气中燃烧之后,剩下的是水、碳酸气和氮气。因此,它们燃烧所使用的装置需适合收集这三种产物,因此也就比炭炉更为复杂。
我用于这个目的装置由一个大广口瓶或罐子A(图版XII,图4 )组成,在其上缘DE处的外围适当粘接一道铁边,在BC处收口,以便在BC与广口瓶的外壁之间留下一道略深于两吋的沟或槽。广口瓶的盖子(图5 )也围有一道铁边fg ,铁边适合放进盛满汞的槽xx (图4 )之中,盖子具有不用封泥就马上密封住广口瓶的作用;由于槽将容纳约两吋汞,因此,可以使广口瓶的空气承受两呎多水的压力而没有使其泄出的危险。
盖子有Thik 四个孔,以使同样数目的管子通过。开口T装有一个皮盒,通过皮盒的是一个打算用来升降灯芯的杆,此杆以后将指出。其他三个孔打算用来通过三个不同的管子,其中一个把油输送到灯,第二个输送维持燃烧的空气,第三个在空气起燃烧作用之后将其送出。油在其中燃烧的灯如图2 所绘;a 是贮油器,有一个用来盛油的漏斗;bcdefgh 是把油输送给灯11的虹吸管;7、8、9、10是为燃烧把空气从气量计输送给同一盏灯的管子,管子bc 下端b 在外部形成一个阳螺旋,旋进贮油器a 的盖子中的阴螺旋之中;以便通过某种方式旋转贮油器,使其上升或下降,以此把油保持在必须的水平上。
要注满虹吸管并连通贮油器和灯时,将活塞c 关上,将e 处打开,从虹吸管顶部的开口f 注入油直至油在里面上升至灯上缘的三或四吩;然后关上活塞k ,将c 处打开;然后在f 处注入油至将虹吸管分支bcd 注满,然后关上活塞e 。此时虹吸管的两个分支完全盛满,贮油器和灯完全连通。
图版XII图1 中放大绘出了灯(图2 )的所有部件以清楚地显示它们。管子ik 把油从贮油器输至容纳灯芯的腔aaaa ;管子9、10将空气从气量计引出以维持燃烧;此空气通过腔dddd 扩散,并且靠通道cccc 和bbbb ,按照阿甘德(Argand)、奎因奎特(Quinquet)和兰格(Lange)提出的灯具原理分配到灯芯的每一边。
为使这整个复杂装置更易于理解,以及以此装置的说明能够使所有其他相同种类的装置更易于领会,图版XI 中描绘了完全连接起来以供使用的装置。气压计P通过管子和活塞1、2为燃烧提供空气;管子2、3与第二个气量计相连,在此过程中当第一个气量计空了时将第二个气量计充满,以能不使燃烧中断;4、5是一个充满潮解性盐的玻璃管,用以在空气通道中尽可能地干燥空气;由于在实验开始时已知此管及其所容纳盐的重量,因此也就容易确定这些盐从空气中所吸收的水量。由此潮解管空气通过导管5、6、7、8、9、10传导至灯11,在这里如前所述扩散到灯芯的两边,供给火焰。此空气的一部分,即用以维持油燃烧的部分,通过氧化其元素而形成碳酸气。此水部分凝结在A罐的壁上,另一部分靠燃烧提供的热素而在空气中处于溶化状态。此空气受气量计之压通过管子12、13、14、15,进入瓶子16和蛇管17、18,在这里,水由于空气的冷却而完全凝结;如果还有任何水仍处于溶化状态的话,也被管子19、20所容纳的潮解盐所吸收了。
所有这些措施都只是用来收集和确定实验过程中形成的水量的;碳酸和氮气仍有待确定。前者用瓶子22和25中的苛性碱溶液来吸收。我在图中只绘出了两个瓶子,但是至少需要九个;这一系列瓶子中的最后一个可以半充满石灰水,石灰水是指示碳酸存在的最可靠的试剂;如果石灰水不变混浊,我们就可以确信该酸在此空气中的量察觉不到。
已经供燃烧之用剩下的空气虽然仍混有相当分量的未经过燃烧、未发生变化的氧气,但却主要由氮气组成,此空气通过第三个潮解盐管28、29而失去其在碱溶液瓶子和石灰水瓶子中可能已经获得的水分,由此通过管子29、30进入一个气量计之中,在这里确定其量。然后用它做小试验,使其受硫化草碱的作用,以确定它所含的氧气和氮气的比例。
在油的燃烧中,灯芯最终被烧焦,妨碍油的上升;此外,如果我们把灯芯升到一定高度之上,那么,通过其毛细管上升的油就多于能够消耗的空气流,也就产生了烟。因此,必须不打开装置就能够延长或缩短灯芯;这靠杆子31、32、33、34来完成,它通过一个皮盒与灯芯支座相连;而且,此杆的运动,因而灯芯的运动就可以极光滑极灵巧地得到调节,它通过在齿轨上运转的一个小齿轮随意移动。图版XII图3 描绘的就是此杆及其附件。据我看来,似乎用图版XII 中所绘两头开口的小玻璃广口瓶将灯焰围住,会助燃。
我不必更详尽地描述此装置的建造,此装置在许多方面仍然可以改动和调整,我只是要补充说,要在实验中使用此装置时,必须精确称量容纳了油的灯和贮油器,此后再像前面指出的那样将其放置并点燃;然后在气量计和灯中的空气相通之后,用一个板子BC和两根铁杆将外面的广口瓶A(图版XI )从上到下固定起来并弄紧,铁杆与板子和盖子相连并且用螺丝拧住。在广口瓶调整盖子时,就有少量油燃烧,而此燃烧的产物失去了;同时,来自气量计的空气也有少量损失。这二者在范围广泛的实验中无足轻重,而且在我们的计算中甚至可以估算它们。
在一篇详尽的论文中,我将向科学院说明与这种实验分不开的种种困难。这些困难如此难以克服、如此令人烦恼,以致我迄今还完全不能严密确定产物的量。然而,我已经有充分证据证明,固定油在燃烧过程中完全分解成为水和碳酸气,因此它们是由氢和炭组成的;不过,我还没有把握知道这些成分的比例。
第五节 论醇燃烧
醇的燃烧在已经描述了的适合于炭和磷燃烧的装置中很容易就可以完成。将一盏盛满醇的灯置于广口瓶A(图版IV,图3 )之下,把一点点磷放在灯芯上,如前所述,灯芯用赤铁点着。然而,这个方法有极不方便之嫌;在实验开始时使用氧气以免爆燃,这是危险的,使用普通空气时甚至都发生爆燃。最近在科学院的一些成员面前,就有一个对我本人来说证明是致命的事例。我没有像往常那样在要做实验时准备实验,而是在前一个晚上就将一切都安排妥当;因此,广口瓶的大气就有足够的时间溶解大量的醇;这种蒸发甚至被汞柱的高度大大促发,我已经将汞柱升至EF(图版IV,图3 )处。我一试图用炽热铁将一点点磷点着,就发生了剧烈的爆炸,把广口瓶猛向实验室的地面上抛击,将其击成无数碎片。
因此,我们用这种方式只能处理非常少量譬如十或十二格令的醇;而在处理量这么少的实验中可能犯的错误就会妨碍我们信任其结果。在载于《科学院文集》1784年第593页的实验中,我曾通过首先在普通空气中点燃醇,然后按照消耗的比例给广口瓶提供氧气,尽力使燃烧延长;但是此过程产生的碳酸气成为燃烧的极大障碍,以致醇更难以燃烧,尤其比在普通空气中更糟,结果用这种方式甚至连极少量的都不能燃烧。
也许这种燃烧在油装置(图版XI )中会较为成功;不过我迄今尚未敢去试。燃烧在其中完成的广口瓶大小接近1400立方吋;假若在这样一个容器中发生爆炸,其后果就会极糟,而且极难防范。然而,迄今我还没有丧失进行尝试的信心。
由于所有这些困难,迄今我只得把我的实验限于对极少量醇的实验,或者至少是限于诸如图版IX图5 中所绘的敞开容器中所进行的燃烧,此容器将在本章第七节加以描述。如果我任何时候能够消除这些困难,我就将重新开始这种探索。
第六节 论醚燃烧
虽然醚在封闭容器燃烧不出现与醇燃烧相同的困难,然而,它却含有某种不同的、更不易克服的困难,仍然妨碍我的实验进展。我竭力利用了醚所具有的溶解于大气并且使其变得易燃而不爆炸的性质。为此目的,我建造了一个贮醚器abcd (图版XII图8 ),空气通过管子1、2、3、4从气量计送至贮醚器。此空气首先在贮醚器的双盖中扩散,由此通过ef 、gh 、ik 等7个下端通往醚的底部的管子,并且受气量计之压通过贮醚器中的醚而沸腾。我们可以用一个附加的贮醚器E,按照被空气溶解并被带走的醚的比例,恢复第一个贮醚器中的醚,附加的贮醚器用一个十五或十八吋长的黄铜管及一个活塞连接。连接管的这个长度使下降的醚能够战胜来自气量计的空气的压力所引起的阻抗。
于是,载有醚蒸气的空气就由管子5、6、7、8、9通往广口瓶A,让它在广口瓶中从一个毛细口逸出,在其终端点火。空气满足了燃烧之目的时,就通过瓶子16(图版XI ),蛇管17、18及潮解管19、20,此后通过碱瓶;在这些瓶子中,其碳酸气被吸收,而实验过程中形成的水则在装置的前面部件中已经先沉积下来。
我让人建造这个装置时,我曾假定大气和醚在贮醚器abcd (图版XII图8 )中是以维持燃烧的恰当比例形成化合物的;但是我在这一点上错了;因为有许多过量的醚;以致使其充分燃烧必须有一定量的补充大气。因此,根据这些原理建造的灯要在普通空气中点燃,普通空气提供燃烧所必需的氧量,不过,灯不能在封闭的容器中点燃,空气在封闭的容器中得不到更换。由于这个情况,我的醚灯在点燃并关闭在广口瓶A(图版XII图8 )中之后不久就熄灭了。为补救这个不足,我曾用侧管10、11、12、13、14、15给灯送大气,我把大气环绕火焰进行分配;但是,火焰极端稀薄,以致最柔和的空气流就将其吹熄了,结果我迄今还没在燃烧醚方面取得成功。然而,我还没有丧失能够用我即将对此装置进行的某些改变来完成它的信心。
第七节 论氢气燃烧与水的形成
在形成水时,在燃烧之前皆处于气态的氢和氧这两种物质通过这种操作转变成为液体或水。如果能够得到完全纯净的这两种气体,以致它们可以燃烧而无任何残留物的话,这个实验就非常容易,而且只需非常简单的仪器。在这种情况中,我们可以在非常小的容器中操作,而且,按适当比例不断提供两种气体,我们就可以使燃烧无限持续下去。但是,迄今化学家们仅仅使用了混有氮气的氧气;由于这种情况,他们只能在封闭的容器中使氢气的燃烧维持非常有限的时间,因为,由于氮气残留物不断增加,空气最后变得如此之赃致使火焰变弱而熄灭。这种麻烦随所使用的氧气的不纯程度而变大。由于这种情况,我们要么必须满足于处理的量少,要么必须不时地抽空容器,以除去氮气残留物;但是,在这种情况中,实验过程中形成的一部分水因抽气而蒸发;而引起的误差对此方法的精确性来说是较危险的,使得我们没有估计它的可靠手段。
这些考虑使我想用完全没有掺和任何氮气的氧气来重复气体化学的主要实验;这可以从氧化盐酸草碱获得。从此盐提取的氧气除非偶然,似乎不合氮,以致通过适当的措施可以获得完全纯的氧气。在此期间,第一部分第八章水重组实验中所述默斯尼尔先生和我用来燃烧氢气的装置,将符合这个意图,这里不必重述此装置;当获得了纯气体时,除了可以缩小容器的容量之外,这个装置将不需要改动。见图版IV图5 。
燃烧一旦开始,就持续相当的时间,但却随着燃烧留下的氮气量增加的比例而逐渐减弱,直至最后氮气超过这样的比例,使燃烧不再能够维持,火焰熄灭。必须防止这种自发的熄灭,因为由于氢气在其贮存器中受一吋半水的压力,而氧气只承受三吩的压力,因此在球形瓶中就会发生二者的混合,而混合物就会被较大的压力压进氧气贮存器之中。因此,每当火焰变得非常微弱时,就必须关闭管子d Dd '的活塞来中止燃烧;为此目的,必须留意守视它。
还有另外一种燃烧装置,虽然我们不能用它以与用上述装置同样一丝不苟的精确性来完成实验,但这种装置却给出极端适合于在各门哲学化学课程中演示的引人注目的结果。它由一个置于金属冷却器ABCD中的蛇管EF(图版IX,图5 )组成。此蛇管的上部E固定着烟筒GH,烟筒由两个管子组成,内管是蛇管的延续,外管是一个镀锡铁皮套,铁皮套约在一时距离处围住内管,间隔中填满沙。在内管下端K固定一个玻璃管,我们给它配一盏阿甘德灯LM用以燃烧醇等等。
器具这样安排妥当,灯充满一定量的醇时,就点火;燃烧过程中形成的水在烟筒KE中上升,在蛇管中凝结,在其F端流出进入P瓶。间隔中填满了沙的烟筒双管用来防止管子在其上部冷却,防止使水凝结;否则,它就会在管中落回来,我们就不能确定其量,而且它会一滴一滴地落到灯芯上使火焰熄灭。这种建构的意图是使烟筒总是保持热的状态,使蛇管总是保持冷的状态,以使水上升时可以维持处于蒸气状态,并且一进入装置的倾斜部分就能够立即凝结。此装置由默斯尼尔先生设计,我在《科学院文集》1784年第593页曾加以描述,我们用这个装置,注意总是保持蛇管处于冷的状态,就可以从燃烧十六盎司醇而收集到差不多十七盎司水。
第八节 论金属氧化
氧化或煅烧这个术语主要用来表示金属受一定程度的热,通过吸收空气中的氧而转化成为氧化物的过程。这种化合的发生,是由于氧在一定的温度所具有的对金属的亲和力,比对以游离态离析的热素的亲和力大的缘故;但是,由于这种离析在普通空气中发生时是缓慢而渐进的,因此人们的感觉几乎不明显。然而,当氧化发生于氧气中时,情况就完全不是这样了;因为此氧化的产生快得多,一般伴有热和光。以致明显地显示出金属物质是真正的可燃物体。
所有的金属对氧并非都有相同的亲和度。譬如,金、银和铂甚至在已知最强的热中都不能从它与热素的化合物中将其夺走;而其他金属则大量或少量吸收它,直至金属对氧的亲和力以及后者对热素的亲和力处于严格的平衡。的确,可以假定亲和力的这种平衡状态在所有化合物中是一条普遍的自然规律。
在所有这种性质的操作中,给空气提供畅通无阻的通路,可以加速金属的氧化;结合风箱的作用,有时候对氧化大有帮助,风箱把空气流直接送至金属表面。如果用氧气流,这个过程就快得多,这靠前面所述的气量计就容易做到。在这种情况中,金属发生耀眼的光辉,氧化完成得非常快;但是这种方法因为花费制得的氧气而只能在非常有限的实验中使用。在矿石试验及所有普通的实验室操作中,金属的煅烧或氧化通常都是在置于坚固炉子中通常称为烤钵(roasting test )的烧制陶盘(图版IV,图6 )中完成的。为了把另外的表面朝着空气,常常拌动要氧化的物质。
每当完成的操作所处理的金属不是挥发性的并且在这个过程中没有什么东西由之挥发进入周围空气之中时,该金属就得到额外的重量;但是,氧化过程中重量增加的原因从来就没能靠畅通空气中完成的实验发现过;而且,关于这种现象的原因所形成的任何猜想,仅仅是由于在封闭的容器和确定量的空气中完成了这些操作。用于此目的的第一种方法归功于普里斯特利博士,他把要煅烧的金属放在一个瓷杯N(图版IV,图11 )中,瓷杯放在广口瓶A之下的支加IK上,广口瓶放在盛满水的池子BCDE之中;用虹吸管吸出空气使水上升到GH,并使取火镜的焦距落到金属上。氧化一发生,空气中所含的部分氧就与金属化合,并且引起空气体积按比例减少;剩下的不外是氮气,不过其中仍混有少量氧气。我在我1773年首次出版的《物理学和化学论集》(Physical and Chemical Essays )中,说明了用这套装置所做的一系列实验。在这个实验中可以用汞代替水,靠此使结果更具有结论性。
用于此目的的另一种方法是波义耳先生发明的,我在《科学院文集》1774年第351页曾对此加以说明。将金属导入曲颈瓶(图版III,图20 )中,密封住其鸟嘴口;然后极谨慎地加热使该金属氧化。用这种方法,在曲颈瓶末端破裂之前,容器及其所盛物质的重量完全不变;但是,当末端破裂时,外部空气就嘶嘶地冲进去。如果不在密封曲颈瓶之前通过加热赶出部分空气,这种操作就有危险,因为不然的话,当曲颈瓶置于炉子中时,它就会由于空气的膨胀而容易爆裂。赶出的空气的量可以接收在气体化学装置中的广口瓶之下,由此广口瓶确定此量及曲颈瓶中所剩下的空气量。我所增加的关于金属氧化的实验并没有我所希望的那么多;除了锡之外,我处理任何金属也都没有得到令人满意的结果。要是某个人能够在几种气体中做一系列金属氧化实验就太好了;这是一个重大主题,完全会补偿这种实验可能引起的麻烦。
由于汞的所有氧化物不加成就能使它们以前所吸收的氧气再生和恢复,因此,它似乎是结论性的氧化实验主题最合适的金属。以前,我曾力图通过把盛有少量汞的曲颈瓶充满氧气,并给其鸟嘴口配上一个半充满相同气体的膀胱,在封闭的容器中完成汞的氧化;见图版IV图12 。后来,通过在曲颈瓶中非常长时间地加热汞,我成功地氧化了一小份,结果形成了一点漂浮在流动汞面上的红色氧化物;但是,此量如此之少,以致在确定操作前后氧气量时所产生的最小误差,都必定使实验结果带来很大的不确定性。而且,我对这种方法也不满意,不无缘由地唯恐空气通过膀胱微孔泄漏出去,当它没用布盖住使其不断维持潮湿状态,因炉热而枯皱时,尤其如此。
这个实验用《科学院文集》1775年第580页所描绘的装置来完成就更加肯定。此装置由一个曲颈瓶A(图版IV,图2 )组成,其鸟嘴口熔接有一个内径为十或十二吩的弯玻璃管BCDE,伸在口朝下倒立在盛满水或汞的池子中的玻璃钟罩FG之下。曲颈瓶置于炉子MMNN(图版IV,图2 )炉栅上或沙浴中,靠此装置我们可以在几天期间在普通空气中氧化少量汞;红色氧化物漂在面上,由此它可以收集和再生,以便将再生得到的氧气量与氧化过程中吸收的氧气量进行比较。这种实验只能小规模地完成,以致由它们不能引出非常可靠的结论 (1) 。
这里应当提到,铁在氧气中的燃烧是该金属的真正氧化。图版IV图17 中所绘的,便是英根豪茨 (2) 先生用来进行这种操作的装置;不过,由于已经在第三章中充分加以叙述,我请读者查阅该处所讲的内容。也可以用已经指出过的燃烧磷和炭的方式,通过在充满氧气的容器中燃烧,来氧化铁。此装置如图版IV图3 中所绘,如本书第一部分第五章中所述。我们从英根豪茨先生那里认识到,除了金、银、汞之外的所有金属,弄成非常细的丝或者截成窄条的极薄的薄片,可以用同样方式燃烧或氧化;这些金属与铁丝一起扭转,它把燃烧性质传递给其他金属。
汞甚至在畅通的空气中都难以氧化。在化学实验室里,这个过程通常在一个长颈卵形瓶A(图版IV,图10 )中进行,该卵形瓶有非常扁平的瓶体和非常长的瓶颈BC,此器皿通常称为波义耳巢(Boyle's hell )。导入的汞量足以盖住瓶底,将其置于沙浴之中,沙浴保持的持续的热接近使汞沸腾。用五或六个类似的长颈卵形瓶继续这种操作几个月,不时地更新汞,最后得到几盎司红色氧化物。此装置极缓慢极不方便是由于不充分更换空气引起的;但是另一方面,如果与外部空气的循环过于流畅,就会夺走蒸气状态的溶化汞,以致容器中几天之内都不会留下任何东西。
由于在所有的金属氧化实验中,竟然只有用汞做的实验最具结论性,因此,要是发明一个简单的装置,能够在大学化学课程中演示这种氧化并论证其结果该有多好。依照我的看法,这可以用与我已经描述过的燃烧炭和油相似的方法来完成;不过,由于其他事务,我迄今还未能重新开始这种实验。
氧化汞经加热至微微炽热,不加成而再生。在此温度中,氧对热素的亲和力大于它对汞的亲和力而形成氧气。此氧气总是混有一小份氮气,这表明在氧化过程中吸收了一小份后一种气体。它几乎总是含有少量碳酸气,这归因于该氧化物的污染物是必定无疑的;这些污染物受热炭化,把部分氧气转化成为碳酸。
假若化学家们非要在他们的实验中使用从经过非加成加热氧化了,即所谓煅烧了或自脱溶了(precipitated perse )的汞获得的所有氧气不可的话,那么,氧气制备的过分昂贵就会使甚至中等规模的实验成为完全行不通的。但是汞也可以用硝酸氧化;用这种方式,我们甚至获得比煅烧制得的更纯的红色氧化物。我有时候用在曲颈瓶中或在长颈卵形瓶和曲颈瓶碎片形成的小皿中,用前述方式将汞溶解于硝酸,蒸发至干,并煅烧此盐,而制备这种氧化物;但是,我用药商销售的、我认为是从荷兰购进的氧化汞,从来没有同样成功地制得过氧气。排选氧化汞时,我们应当选择由表面光滑的黏附鳞状物组成的硬块,因为粉状掺杂有红色氧化铅。
为了从红色氧化汞得到氧气,我通常用一个瓷质曲颈瓶,其鸟嘴口上配有一个长玻璃管,放在水气体化学装置中的广口瓶之下,我并且在管子的末端把一个瓶子放在水中,按汞再生和馏出的比例接收它。由于直至曲颈瓶变红才有氧出现,这似乎证明了贝托莱先生所确立的暗热决不能形成氧气以及光是其组成元素之一的原理。我们必须抛弃最初的一份气体,因为该气体混有普通空气,此普通空气在实验开始时就盛于曲颈瓶之中了;不过,甚至用这种措施,所获得的氧气也常常被十分之一的氮气和极少量的碳酸气所污染。使气体通过苛性碱溶液,容易去掉后者;但是,我们知道,没有什么方法分离氮气;然而,使已知量的氧气被氮气污染两周,并与硫化苏打或硫化草碱接触,硫化物吸收氧气使硫转化成硫酸,留下纯氮气,由此就可以确定氮气的比例。
使黑色氧化锰或硝酸苏打在已经描述过的处理红色氧化汞的装置中经受炽热,我们还可以由它们获得氧气;不过,由于它所需要的热至少能使玻璃变软,因此我们必须使用石质或瓷质曲颈瓶。但是,最纯和最好的氧气是经简单加热从氧化盐酸草碱离析出的。此操作在玻璃曲颈瓶中完成,而且,如果抛弃了混有容器中所盛空气的最初一份气体,得到的气体就极纯。
————————————————————
(1) 见第一部分第三章对这个实验的说明。——A
(2) 此处英文版将“英根豪茨”拼为“Ingenhousz”。——C
